Молярная масса меди
Молярная масса меди
Порядковый номер – 29. Строение атома показано на рис. 1. Металл d-семейства.
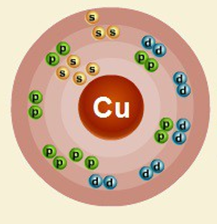
Рис. 1. Схема строения атома меди.
В обычных условиях медь представляет собой вещество красного цвета с гранецентрированной кубической решеткой. Характеризуется исключительной пластичностью и превосходит другие металлы по теплопроводности и электрической проводимости. Плотность 8,94 г/см3. Температура плавления 1084,5oC, кипения 2540oC.
Молярная масса меди равна 63,546 г/моль. Данное значение показывает отношение массы вещества (m) е число моль данного вещества (n), обозначается M и может быть рассчитано по формуле:
M = m / n.
Иными словами, молярная масса вещества – это масса 1 моль данного вещества, выраженная в г/моль или ккмоль.
Медь не может существовать в виде газа, только в форме твердого вещества, поэтому для нахождения значения его молярной массы нельзя использовать величину молярного объема или производить расчеты по формуле Менделеева-Клапейрона.
Примеры решения задач
| Задание | Напишите уравнения реакций, с помощью которых можно осуществить следующие реакции:
CuO → CuSO4 → Cu → CuO → Cu(NO3)2. |
| Ответ | При растворении оксида меди (II) в разбавленной серной кислоте образуются сульфат меди (II) и вода:
CuO+ H2SO4(dilute)→ CuSO4 + H2O. Медь из сульфата меди (II) можно получить гидрометаллургическим методом: CuSO4+ Fe→ Cu + FeSO4. При температуре свыше 337oC медь взаимодействует с кислородом с образованием оксида меди (II): 2Cu+ O2 → 2CuO; Оксид меди (II) растворяется в разбавленной азотной кислоте с образованием нитрата меди (II) и воды: CuO+ HNO3(dilute)→ Cu(NO3)2 + H2O. |
| Задание | В водный раствор хлорида меди (II) опустили медные электроды по 20 г каждый и подключили их к источнику постоянного тока. Через некоторое время катод вынули и растворили при нагревании в концентрированной серной кислоте, а затем добавили в раствор избыток гидроксида натрия, в результате чего выпал осадок массой 49 г. Определите массу анода после электролиза. |
| Решение | Запишем уравнения реакций:
катод: Cu2+ +2e→ Cu0; (1) анод: Cu0 — 2e→ Cu2+. (2) Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O; (3) CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4; (4) Рассчитаем количество вещества гидроксида меди (II) (осадка) (молярная масса равна 98г/моль): n = m / M; n(Cu(OH)2) = m (Cu(OH)2) / M (Cu(OH)2); n (Cu(OH)2) = 49 / 98 = 0,5 моль. Определим количество вещества и массу меди (катода) по окончании реакции (молярная масса – 64 г/моль): mfinal(Cu) = n(Cu(OH)2) =0,5 моль; m = n × M; mfinal(Cu) = n (Cu)× M (Cu); mfinal(Cu)= 0,5 × 64 = 32г. Найдем массу меди, осажденной на катоде: m(Cu) = mfinal(Cu) – mparent(Cu); m(Cu) = 32 – 20 = 12 г. Вычислим массу анода по окончании реакции. Масса анода уменьшилась ровно настолько, насколько увеличилась масса катода: manode =mparent(anode) — m(Cu); manode = 20 – 12 = 8 г. |
| Ответ | Масса анода равна 8 г |











