Молярная масса марганца
Молярная масса марганца
Порядковый номер – 25. Строение атома показано на рис. 1. Металл d-семейства.
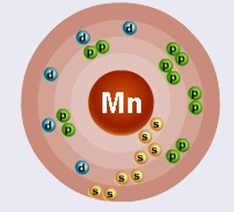
Рис. 1. Схема строения атома марганца.
В обычных условиях марганец представляет собой вещество серебристо-белого цвета. Способен существовать в виде нескольких модификаций, каждая из которых устойчива в определенном интервале температур. Плотность – 7,44 г/см3. Температуры плавления и кипения равны 1245oC и 2080oC, соответственно.
Молярная масса марганца равна 54,9380 г/моль. Данное значение показывает отношение массы вещества (m) е число моль данного вещества (n), обозначается M и может быть рассчитано по формуле:
M = m / n.
Иными словами, молярная масса вещества – это масса 1 моль данного вещества, выраженная в г/моль или ккмоль.
Марганец не может существовать в виде газа, только в форме твердого вещества, поэтому для нахождения значения его молярной массы нельзя использовать величину молярного объема или производить расчеты по формуле Менделеева-Клапейрона.
Примеры решения задач
| Задание | Марганец получают восстановлением кремнием оксида марганца (III). Технический оксид массой 20 г (массовая доля примесей равна 5,2%) восстановили до металла. Рассчитайте массу полученного марганца. |
| Решение | Запишем уравнение реакции восстановления оксида марганца (III) кремнием до марганца:
2Mn2O3 + 3Si = 3SiO2 + 4Mn. Рассчитаем массу оксида марганца (III) без примесей: ωpure(Mn2O3) = 100% — ωimpurity; ωpure(Mn2O3) = 100% — 5,2 = 94,8% = 0,984. mpure(Mn2O3) = mimpurity(Mn2O3) × ωpure(Mn2O3) / 100%; mpure(Mn2O3) = 20 × 0,984 = 19,68 г. Определим количество вещества оксида марганца (III) (молярная масса – 158 г/моль): n = m / M; n (Mn2O3) = m (Mn2O3) / M (Mn2O3); n (Mn2O3) = 19,68 / 158 = 0,12моль. Согласно уравнению реакции n(Mn2O3) :n(Si) = 2:3, значит, n(Si) = 3/2×n(Mn2O3) = 3/2×0,12 = 0,2 моль. Тогда масса кремния будет равна (молярная масса – 28 г/моль): m = n × M; m (Si) = n(Si) × M (Si); m (Si) = 0,2 × 28 = 5,6 г. |
| Ответ | Масса кремния 5,6 г |
| Задание | Вычислите массу перманганата калия, который необходим для окисления сульфита калия массой 7,9 г в нейтральной среде. |
| Решение | Запишем уравнение реакции окисления сульфита калия перманганатом калия в нейтральной среде:
2KMnO4 + 3K2SO3 + H2O = 2MnO2 + 3K2SO4 + 2KOH. Рассчитаем число моль сульфита калия (молярная масса – 158 г/моль): n = m / M; n (K2SO3) = m (K2SO3) / M (K2SO3); n (K2SO3) = 7,9 / 158 = 0,05моль. Согласно уравнению реакции n(K2SO3) :n(KMnO4) = 3:2, значит, n(KMnO4) = 2/3 × n(K2SO3) = 2/3 × 0,03 = моль. Масса перманганата калия необходимого для окисления сульфита калия в нейтральной среде равна (молярная масса – 158г/моль): m = n × M; m (KMnO4) = n (KMnO4) × M (KMnO4); m (KMnO4) = 0,03 × 158 = 4,74 г. |
| Ответ | Масса перманганата калия равна 4,74 г |











