Молярная масса кремния
Молярная масса кремния
Порядковый номер – 14. Строение атома показано на рис. 1. Неметалл p-семейства.
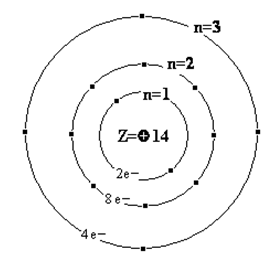
Рис. 1. Схема строения атома кремния.
В обычных условиях представляет собой вещество темно-серого цвета. По внешнему виду похож на металл. Может существовать в виде алмазоподобной (кубической) (устойчивая) и графитоподобной (неустойчивая)модификаций. Тугоплавок – температура плавления равна 1415oC. Характеризуется высокой твердостью.
Молярная масса кремния равна 28,0855 г/моль. Эта величина представляет собой отношение массы (m) вещества к его количеству (n):
M = m / n.
Молярную массу обычно выражают в г/моль, реже в кг/кмоль. Поскольку в одном моле любого вещества содержится одинаковое число структурных единиц, то молярная масса вещества пропорциональная массе соответствующей структурной единицы, т.е. относительной атомной массе данного вещества (Mr):
M = κ × Mr,
где κ – коэффициент пропорциональности, одинаковый для всех веществ. Относительная молекулярная масса – величина безразмерная. Её вычисляют, используя относительные атомные массы химических элементов, указанных в Периодической системе Д.И. Менделеева.
Примеры решения задач
| Задание | Для получения кремния из оксида кремния (IV) в качестве восстановителя применяют кокс:
SiO2 = 2C = Si + 2CO. Рассчитайте массу оксида кремния (IV), который можно восстановить с помощью кокса массой 50 г (массовая доля углерода в коксе составляет 95%). |
| Решение | Запишем уравнение реакции восстановления оксида кремния (IV) коксом:
SiO2 = 2C = Si + 2CO. Определим массу углерода: m(C) = m(coke) ×ω(C)/100%; m(C) = 50 ×95/100% = 47,5 г. Рассчитаем количество вещества углерода (молярная масса – 12 г/моль): n = m / M; n(С) = m(С) / M(С); n(С) = 47,5 / 12 = 3,96 моль. Согласно уравнению реакции n(С) : n(SiO2) = 2:1, значит: n(SiO2) = 1/2 × n(С); n(SiO2) = 0,5 × 3,96 = 1,98 моль. Тогда, масса оксида кремния (IV) (молярная масса – 60 г/моль) будет равна: m = n × M; m(SiO2) = n(SiO2) × M(SiO2); m(SiO2) = 1,98 × 60 = 118,75 г. |
| Ответ | Масса оксида кремния (IV) равна 118,75 г |
| Задание | Вычислите массу кремния, который может прореагировать с горячим раствором щелочи объемом 200 мл (массовая доля NaOH 35%, плотность 1,38 г/мл). Определите объем водорода, выделяющегося в результате этой реакции. |
| Решение | Рассчитаем массу раствора гидроксида натрия:
msolution = V × ρ; msolution (NaOH) = V(NaOH) × ρ(NaOH); msolution (NaOH) = 200× 1,38 = 276 г. Тогда, масса гидроксида натрия будет равна: msolute = msolution× ω/100%; msolute(NaOH)= msolution(NaOH)× ω(NaOH)/100%; msolute (NaOH)= 276 × 35/100% = 96,6 г. Вычислим количество моль гидроксида натрия (молярная масса – 40 г/моль): n = m / M; n(NaOH) = m(NaOH) / M(NaOH); n(NaOH) = 96,6 / 40 = 2,415 моль. Запишем уравнение реакции взаимодействия кремния с горячим раствором щелочи: Si + 4NaOH = Na4SiO4 + 2H2↑. Согласно уравнению реакции n(NaOH) : n(Si) = 4:1, значит: n(Si) = 1/4 × n(NaOH); n(Si) = 0,25 × 2,415 = 0,6 моль. Тогда, масса кремния (молярная масса – 28 г/моль) будет равна: m = n × M; m(Si) = n(Si) × M(Si); m(Si) = 0,6 × 28 = 16,8г. Для того, чтобы вычислить объем выделившегося водорода, рассчитаем его количество вещества. Согласно уравнению реакции n(NaOH) : n(H2) = 4:2, значит: n(H2) = 1/2 × n(NaOH); n(H2) = 0,5 × 2,415 = 1,25 моль. Тогда, объем выделившегося водорода будет равен: V = n × Vm; V(H2) = n (H2) × Vm; V(H2) = 1,25 × 22,4 = 28 л. |
| Ответ | Масса кремния равна 16,8 г, объем водорода – 28 л |











