Молярная масса кобальта
Молярная масса кобальта
Порядковый номер – 27. Строение атома показано на рис. 1. Металл d-семейства.
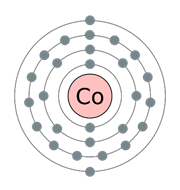
Рис. 1. Схема строения атома кобальта.
В обычных условиях кобальт представляет собой вещество белого цвета с желтоватым оттенком, блестит. Способен существовать в виде нескольких модификаций, каждая из которых устойчива в определенном интервале температур. До 430oC устойчив α-кобальт с гексагональной плотноупакованной решеткой, выше 430oC — β-кобальт с гранецентрированной кубической решеткой.
Молярная масса кобальта равна 58,9332 г/моль. Данное значение показывает отношение массы вещества (m) е число моль данного вещества (n), обозначается M и может быть рассчитано по формуле:
M = m / n.
Иными словами, молярная масса вещества – это масса 1 моль данного вещества, выраженная в г/моль или ккмоль.
Кобальт не может существовать в виде газа, только в форме твердого вещества, поэтому для нахождения значения его молярной массы нельзя использовать величину молярного объема или производить расчеты по формуле Менделеева-Клапейрона.
Примеры решения задач
| Задание | Кобальт массой 2,95 г растворили в соляной кислоте, при этом образовалась соль кобальта (II), через полученный раствор пропустили сероводород. Определите массу образовавшегося осадка. |
| Решение | Запишем уравнения реакций, о которых говорится в условии задачи:
Co + 2HCldilute = CoCl2 + H2↑ (1); CoCl2 + H2S = CoS↓ + 2HCl (2). Найдем количество вещества кобальта, вступившего в реакцию (молярная масса – 59 г/моль): n = m / M; n(Co) = m (Co) / M (Co); n (Co) = 2,95 / 59 = 0,044 моль. Согласно уравнению (1) n (Co) : n (CoCl2) = 1:1, следовательно, n (Co) = n (CoCl2) = 0,044моль. Тогда, количество моль сульфида кобальта (II) (осадок) также будет равно 0,044моль, поскольку n (CoCl2) : n (CoS) = 1:1. Масса сульфида кобальта (II) равна (молярная масса – 91 г/моль): m = n×M; m(CoS)= n (CoS)×M (CoS); m (CoS)= 0,044 × 91 = 4,004 г. |
| Ответ | Масса сульфида кобальта (II) равна 4,004 г |
| Задание | Стандартный электродный потенциал никеля больше, чем кобальта (E0Co2+/Co0 = -0,27 В, E0Ni2+/ Ni 0 = -0,25 В). Изменится ли это соотношение, если измерить потенциал никеля в растворе его ионов с концентрацией 0,001 моль/дм3, а потенциал кобальта – в растворе с концентрацией 0,1 моль/дм3? |
| Решение | Определим электродные потенциалы кобальта и никеля в заданных условиях используя уравнение Нернста:
E’Ni2+/ Ni 0 = E0Ni2+/ Ni 0 – 0,059/n ×lg (aNi2+/ aNi 0); E’Ni2+/ Ni 0 = -0,25 + (0,059/2) × lg10-3; E’Ni2+/ Ni 0 = -0,339 В. E’Co2+/Co0 = E0Co2+/Co0 – 0,059/n ×lg (aCo2+/ aCo0); E’Co2+/Co0 = -0,27 + (0,059/2) × lg10-1; E’Co2+/Co0 = -0,307 В. |
| Ответ | В заданных условиях потенциал кобальта больше, чем потенциал никеля |











