Молярная масса фтора
Молярная масса фтора
M = m / n,
где m – масса в граммах; n–количество вещества в молях.
Молярная масса – постоянная величина для каждого химического элемента или вещества. Численное значение молярной массы совпадает с численным значением относительной молекулярной массы вещества (Mr – число, показывающее, во сколько раз масса молекулы больше 1/12 массы атома углерода) или значением относительной атомной массы элемента (во сколько раз средняя масса атомов химического элемента больше 1/12 массы атома углерода).
Относительная атомная масса атомарного фтора равна 18,9984 а.е.м. Его относительная молекулярная масса будет равна 18,9984, а молярная масса:
M(F) = Mr (F) × 1 моль = 18,9984 г/моль.
Известно, что молекула фтора двухатомна – O2, тогда, относительная атомная масса молекулы фтора будет равна:
Ar(F2) = 18,9984 × 2 = 37,9968 а.е.м.
Относительная молекулярная масса молекулы фтора будет равна 37,9968, а молярная масса:
M(F2) = Mr (F2) × 1 моль = 37,9968 г/моль или просто 38 г/моль.
Фтор представляет собой газ бледно-желтого цвета(схема строения атома представлена на рис. 1). Ядовит. В малых концентрациях запах фтора напоминает запах озона и хлора одновременно.
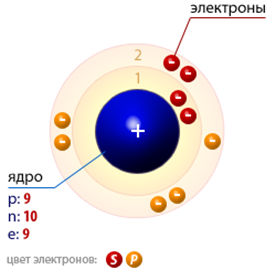
Рис. 1. Строение атома фтора.
Для вычисления молярной массы вещества, находящегося в газообразном состоянии можно использовать и другие походы, например, вести расчет по уравнению Менделеева-Клайпейрона, использовать для этой цели значения молярного объема или плотности газа по отношению к любому другому газу.
Примеры решения задач
| Задание | Рассчитайте относительную плотность по воздуху фтора и фтороводорода. |
| Решение | Известно, что плотность какого-либо газа по воздуху рассчитывается как отношение молярной масса этого газа к молярной массе воздуха (29 г/моль):
Dair = M / Mair. Молярная масса молекулярного фтора равна 38 г/моль, а фтороводорода – 20 г/моль. Тогда плотности фтора и фтороводорода по воздуху будут равны: Dair (F2) = M (F2) / Mair; Dair (F2) = 38 / 29 = 1,31. Dair (HF) = M (HF) / Mair; Dair (HF) = 20 / 29 = 0,6897. |
| Ответ | Плотность фтора во воздуху равна 1,31, фтороводорода – 0,6897 |
| Задание | В каком из соединений галогенов с натрием: NaF, NaBr или NaI самая большая массовая доля галогена? Ответ подтвердите расчетом. |
| Решение | Вычислим молярные массы галогенидов натрия:
M(NaF) = Ar(Na) + Ar(F) = 23 + 19 = 42 г/моль; M(NaBr) = Ar(Na) + Ar(Br) = 23 + 80 = 103г/моль; M(NaI) = Ar(Na) + Ar(I) = 23 + 127 = 150г/моль. Вычислим массовые доли элементов, входящих в состав фторида натрия: ω(Na) = Ar(Na) / M (NaF) × 100%; ω(Na) = 23 / 42 × 100% = 54,76%. ω(F) = Ar(F) / M (NaF) × 100%; ω(F) = 19 / 42 × 100% = 45,24%. Вычислим массовые доли элементов, входящих в состав бромида натрия: ω(Na) = Ar(Na) / M (NaBr) × 100%; ω(Na) = 23 / 103 × 100% = 22,33% ω(Br) = Ar(Br) / M (NaBr) × 100%; ω(Br) = 80 / 103 × 100% = 77,67%. Вычислим массовые доли элементов, входящих в состав иодида натрия: ω(Na) = Ar(Na) / M (NaI) × 100%; ω(Na) = 23 / 150 × 100% = 15,33%. ω(I) = Ar(I) / M (NaI) × 100%; ω(I) = 127 / 150 × 100% = 84,64%. Самая большая массовая доля галогена содержится в иодиде натрия. |
| Ответ | В иодиде натрия |











