Молярная масса бензола
Молярная масса бензола
Строение молекулы бензола показано на рис. 1. В обычных условиях представляет собой бесцветную жидкость со специфическим сладковатым запахом. Токсичен. Способствует развитию онкологических заболеваний. Бензол горит сильно коптящим пламенем. Образует с воздухом взрывоопасные смеси. Смешивается с различными органическими растворителями (эфиры, бензин и др.).
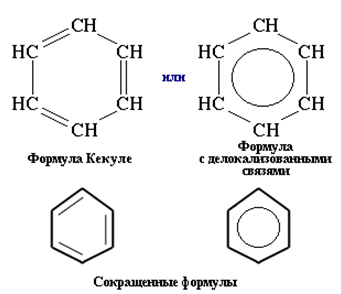
Рис. 1. Строение молекулы бензола.
Брутто-формула бензола – C6H6. Как известно, молекулярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Mr(C6H6) = 6×Ar(С) + 6×Ar(H);
Mr(C6H6) = 6×12 + 6×1 = 72 + 6 = 78.
Молярная масса (М) – это масса 1 моль вещества. Легко показать, что численные значения молярной массы М и относительной молекулярной массы Mr равны, однако первая величина имеет размерность [M] = г/моль, а вторая безразмерна:
M = NA × m (1 молекулы) = NA × Mr × 1 а.е.м. = (NA ×1 а.е.м.) × Mr = × Mr.
Это означает, что молярная масса бензола равна 78 г/моль.
Примеры решения задач
| Задание | Вычислите, какая масса серы потребуется для образования 132 г сульфида железа (II) (FeS), полученного в ходе реакции взаимодействия серы с железом? |
| Решение | Запишем уравнение реакции взаимодействия серы с железом:
Fe + S = FeS. Вычислим количество вещества сульфида железа (II) по формуле: n = m / M; n(FeS)= m (FeS) / M(FeS). Для этого необходимо указать молярную массу сульфида железа (II) (значение относительной атомной массы, взятое из Периодической таблицы Д.И. Менделеева, округлим до целого числа). Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr): M(FeS) = Ar(Fe) + Ar(S) = 56 + 32 = 88 г/моль. Тогда, количество вещества сульфида железа (II) будет равно: n(FeS)= 132 / 88 = 1,5 моль. Согласно уравнению реакции n(FeS) :n(S) = 1 : 1, значит: n(S) = n(FeS) = 1,5 моль. Найдем молярную массу серы (допущение, указанное при расчете молярной массы кислорода действительно и в данном случае): M(S) = Ar(S) = 32 г/моль. Определим массу серы: m = n × M; m(S) = n (S) × M (S); m(S) = 1,5 × 32 = 48 г. |
| Ответ | Масса серы равна 48 г. |
| Задание | Вычислите, какая масса кислорода потребуется для получения 2 г оксида магния? |
| Решение | Запишем уравнение реакции взаимодействия магния с кислородом:
2Mg + O2 = 2MgO. Вычислим количество вещества оксида магния по формуле: n = m / M; n(MgO)= m (MgO)/ M(MgO). Для этого необходимо указать молярную массу оксида магния (значение относительной атомной массы, взятое из Периодической таблицы Д.И. Менделеева, округлим до целого числа). Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr): M(MgO) = Ar(Mg) + Ar(O) = 24 + 16 = 40 г/моль. Тогда, количество вещества оксида магния будет равно: n(MgO)= 2 / 40 = 0,05 моль. Согласно уравнению реакции n(O2) :n(MgO) = 1 : 2, значит: n(O2) = 1/2 × n(MgO) = 1/2 × 0,05 = 0,025 моль. Найдем молярную массу кислорода (допущение, указанное при расчете молярной массы кислорода действительно и в данном случае): M(O2) = 2×Ar(O) = 2×16 = 32 г/моль. Определим массу кислорода: m = n × M; m(O2) = n (O2) × M (O2); m(O2) = 0,025 × 32 = 0,8 г. |
| Ответ | Масса кислорода равна 0,8 г. |











