Молярная масса аммиака
Молярная масса аммиака
Молекула аммиака имеет форму тригональной пирамиды (dNH = 0,10 нм, угол HNH равен 107,30) согласно методу валентных связей, это отвечает sp3-гибридизации валентных орбиталей атома азота (рис. 1). Аммиак хорошо растворим в воде: один объем воды растворяет при комнатной температуре около 700 объемов аммиака. Концентрированный раствор содержит 25% (масс.) NH3 и имеет плотность 0,91 г/см3.Раствор аммиака в воде называют нашатырным спиртом.
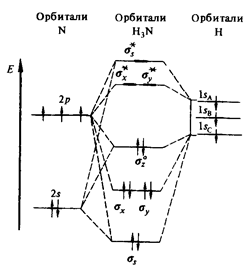
Рис. 1. Энергетическая диаграмма орбиталей молекулы аммиака.
Брутто-формула аммиака – NH3. Как известно, молекулярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Mr(NH3) = Ar(N) + 3×Ar(H);
Mr(NH3) = 14 + 3×1= 14 + 3 = 17.
Молярная масса (М) – это масса 1 моль вещества. Легко показать, что численные значения молярной массы М и относительной молекулярной массы Mr равны, однако первая величина имеет размерность [M] = г/моль, а вторая безразмерна:
M = NA × m (1 молекулы) = NA × Mr × 1 а.е.м. = (NA ×1 а.е.м.) × Mr = × Mr.
Это означает, что молярная масса аммиака равна 17 г/моль.
Примеры решения задач
| Задание | Составьте формулу соединения железа с серой, если соотношение масс элементов в нём m(Fe):m(S) = 7:4. |
| Решение | Для того, чтобы узнать, в каких отношениях находятся химические элементы в составе молекулы необходимо найти их количество вещества. Известно, что для нахождения количества вещества следует использовать формулу:
n = m / M. Найдем молярные массы железа и серы (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел). Известно, что M = Mr, значит (S) = 32 г/моль, а М(Fe) = 56 г/моль. Тогда, количество вещества этих элементов равно: n (S) = m (S) / M (S); n (S) = 4 / 32 = 0,125 моль. n (Fe) = m (Fe) / M (Fe); n (Fe) = 7 / 56 = 0,125 моль. Найдем мольное отношение: n(Fe) :n(S) = 0,125: 0,125 = 1:1, т.е. формула соединения меди с кислородом имеет вид FeS. Это сульфид железа (II). |
| Ответ | FeS |
| Задание | Рассчитайте массу 2 моль газа водорода и число молекул в этом количестве вещества. |
| Решение | Запишем формулу для вычисления количества вещества:
n = m / M. Тогда, массу вещества можно будет рассчитать, как: m = n × M. Найдем молярную массу молекулярного водорода (значение относительной атомной массы, взятое из Периодической таблицы Д.И. Менделеева, округлим до целого числа). Известно, что M = Mr, значит (H2) = 2×Ar(H) = 2×1 = 2 г/моль. Определим массу 2 моль газа водорода: m(Н2) = n (Н2) × M (Н2); m(Н2) = 2 × 2 = 4 г. Число молекул обозначается N и рассчитывается по формуле: N = n × NA. Это безразмерная величина. Найдем число молекул азота в 2 моль этого вещества: N (H2) = 2 × 6,023×10-23 = 12,046×10-23 молекул. |
| Ответ | 4 грамма водорода, 12,046×10-23 молекул |











