Молярная масса алюминия
Молярная масса алюминия
Порядковый номер – 13. Строение атома показано на рис. 1. Металл p-семейства.
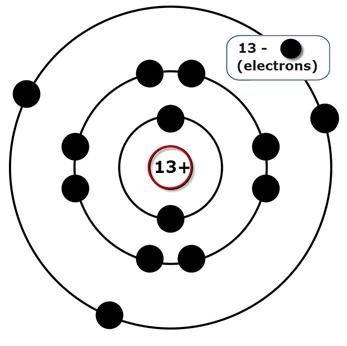
Рис. 1. Схема строения атома алюминия.
В обычных условиях представляет собой вещество серебристо-белого цвета. Легко вытягивается в проволоку и прокатывается в тонкие листы. Кристаллизуется в гранецентрированной кубической решетке. Обладает высокой электрической проводимостью и теплопроводностью. На воздухе быстро покрывается тонким слоем оксида.
Молярная масса алюминия равна 26,9815 г/моль. Эта величина представляет собой массу 1 моль алюминия и выражается в граммах на моль. Расчет молярной массы производят по формуле:
M = m / n.
Молярная масса вещества, выраженная в граммах, численно равна его молекулярной (атомной) массе, выраженной в атомных единицах массы:
M = Ar.
По причине того, что алюминий не может быть переведен в газообразное состояние, для нахождения значения его молярной массы нельзя использовать величину молярного объема или производить расчеты по формуле Менделеева-Клапейрона.
Примеры решения задач
| Задание | Вычислите объем водорода (нормальные условия), который образуется при растворении алюминия массой 8,1 г в водном растворе щелочи. |
| Решение | Так как в условии задачи не указано конкретно, в растворе какой именно щелочи растворили алюминий, то пусть это будет гидроксид натрия. Запишем уравнение реакции:
2Al + 2NaOHconc + 6H2O = 2Na[Al(OH)4] + 3H2↑. Рассчитаем количества вещества алюминия (молярная масса – 27 г/моль): n = m / M; n(Al) = m(Al) / M(Al); n(Al) = 8,1 / 27 = 0,3 моль. Согласно уравнению реакции n(Al) : n(H2) = 2:3, значит, n(H2) = 3/2 × n(Al); n(H2) = 1,5 × 0,3 = 0,45 моль. Вычислим объем выделившегося водорода: V = n × Vm; V(H2) = n (H2) × Vm; V(H2) = 0,45 × 22,4 = 10,08 л. |
| Ответ | Объем водорода равен 10,08 л |
| Задание | Рассчитайте массу осадка, который образуется, если к раствору, содержащему сульфат алюминия массой 7,1 г, прилить избыток водного раствора аммиака. |
| Решение | Запишем уравнение реакции взаимодействия сульфата алюминия с водным раствором аммиака:
Al2(SO4)3 + 6(NH3×H2O)conc., cold = 2Al(OH)3↓ + 3(NH4)2SO4. В результате реакции образовался осадок – гидроксид алюминия. Рассчитаем количество вещества сульфата алюминия (молярная масса – 342 г/моль): n = m / M; n(Al2(SO4)3) = m(Al2(SO4)3) / M(Al2(SO4)3); n(Al2(SO4)3) = 7,1 / 342 = 0,021 моль. Согласно уравнению реакции n(Al2(SO4)3) : n(Al(OH)3) = 1:2, значит: n(Al(OH)3) = 2 × n(Al2(SO4)3); n(Al(OH)3) = 2 × 0,021 = 0,042 моль. Тогда, масса гидроксида алюминия (молярная масса – 78 г/моль) будет равна: m = n × M; m(Al(OH)3) = n(Al(OH)3) × M(Al(OH)3); m(Al(OH)3) = 0,042 × 78 = 3,24 г. |
| Ответ | Масса гидроксида алюминия равна – 3,24 г |











