Непредельные углеводороды. Этилен и его гомологи
Непредельные углеводороды, алкены
Таблица 2. Гомологический ряд алкенов.
| Название химического соединения | Структурная формула |
|---|---|
|
Этен (этилен) |
C2H4 (СH2=CH2) |
|
Пропен (пропилен) |
C3H6 (СH2=CH-CH3) |
|
Бутен |
C4H8 |
|
Пентен |
C5H10 |
|
Гексен |
C6H12 |
|
Гептен |
C7H14 |
|
Октен |
C8H16 |
|
Нонен |
C9H18 |
|
Декен |
C10H20 |
Углеводородные радикалы, образованные от алкенов: — CH=CH2 – винил и –СН2 -СН=СН2 – аллил.
Изомерия
Для алкенов, начиная с бутена, характерна изомерия углеродного скелета:
CH2=CH-CH2-CH3 (бутен-1)
СН2-С(СН3)-СН3 (2-метилпропен-1)
и положения двойной связи:
CH2=CH-CH2-CH3 (бутен-1)
CH3-C=CH-CH3 (бутен-2)
Для алкенов, начиная с бутена-2, характерна геометрическая (цис-транс) изомерия (рис. 1).
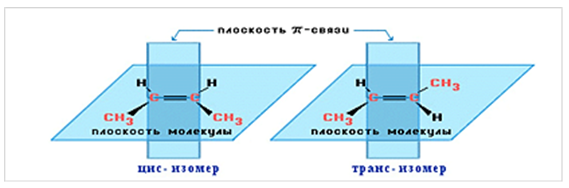
Рис. 1. Геометрические изомеры бутена-2.
Для алкенов, начиная с пропена, характерна межклассовая изомерия с циклоалканами. Так, составу C4H8 отвечают вещества класса алкенов и циклоалканов – бутен-1(2) и циклобутан.
Строение алкенов
Атомы углерода в молекулах алкенов находятся в sp2-гибридицациии: 3σ-связи располагаются в одной плоскости под углом 120![]() друг к другу, а π-связь образована p-электронами соседних атомов углерода. Двойная связь является сочетанием σ- и π-связей.
друг к другу, а π-связь образована p-электронами соседних атомов углерода. Двойная связь является сочетанием σ- и π-связей.
Физические свойства алкенов
При обычных условиях С2-С4 – газы, С5-С17 – жидкости, начиная с С18 – твердые вещества. Алкены не растворимы в воде, хорошо растворимы в органических растворителях.
Получение
Основные способы получения алкенов:
— дегидрогалогенирование галогенпроизводных алканов под действием спиртовых растворов щелочей
CH3-CH2-CHBr-CH3 + KOH = CH3-CH=CH-CH3 + KBr + H2O
— дегалогенирование дигалогенпроизводных алканов под действием активных металлов
CH3-CHCl-CHCl-CH3 + Zn = ZnCl2 + CH3-CH=CH-CH3
— дегидратация спиртов при их нагревании с серной кислотой (t >150![]() C) или пропускании паров спирта над катализатором
C) или пропускании паров спирта над катализатором
CH3-CH(OH)- CH3 = CH3-CH=CH2 + H2O
— дегидрирование алканов при нагревании (500![]() С) в присутствии катализатора (Ni, Pt, Pd)
С) в присутствии катализатора (Ni, Pt, Pd)
CH3-CH2 — CH3 = CH3-CH=CH2 + H2
Химические свойства
Большинство химических реакций алкенов протекают по механизму электрофильного присоединения:
— гидрогалогенирование – взаимодействие алкенов с галогенводородами (HCl, HBr), протекающее по правилу Марковникова (при присоединении полярных молекул типа НХ к несимметричным алкенам водород присоединяется к более гидрированному атому углерода при двойной связи)
CH3-CH=CH2 + HCl = CH3-CHCl-CH3
— гидратация — взаимодействие алкенов с водой в присутствии минеральных кислот (серной, фосфорной) с образованием спиртов, протекающее по правилу Марковникова
CH3-C(CH3)=CH2 + H2O = CH3-C(CH3)OH-CH3
— галогенирование — взаимодействие алкенов с галогенами, например, с бромом, при котором происходит обесцвечивание бромной воды
CH2=CH2 + Br2 = BrCH2-CH2Br
При нагревании смеси алкена с галогеном до 500![]() С возможно замещение атома водорода алкена по радикальному механизму:
С возможно замещение атома водорода алкена по радикальному механизму:
CH3-CH=CH2 + Cl2 = Cl-CH2-CH=CH2 + HCl
По радикальному механизму протекает реакция гидрирования алкенов. Условием протекания реакции является наличие катализоторов (Ni, Pd, Pt), а также нагревание реакционной смеси:
CH2=CH2 + H2 = CH3-CH3
Алкены способны окисляться с образованием различных продуктов, состав которых зависит от условий проведения реакции окисления. Так, при окислении в мягких условиях (окислитель – перманганат калия) происходит разрыв π-связи и образование двухатомных спиртов:
3CH2=CH2 + 2KMnO4 +4H2O = 3CH2(OH)-CH2(OH) +2MnO2 + 2KOH
При жестком окислении алкенов кипящим раствором перманганата калия в кислой среде происходит полный разрыв связи (σ-связи) с образованием кетоноы, карбоновых кислот или углекислого газа:
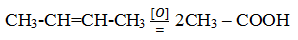
Окисление этилена кислородом при 200![]() С в присутствии CuCl2 и PdCl2 приводит к образованию ацетальдегида:
С в присутствии CuCl2 и PdCl2 приводит к образованию ацетальдегида:
CH2=CH2 +1/2O2 = CH3-CH=O
Алкены вступают в реакции полимеризации. Полимеризация — процесс образования высокомолекулярного соединения – полимера-путем соединения друг с другом с помощью главных валентностей молекул исходного низкомолекулярного вещества – мономера. Полимеризация может быть вызвана нагреванием, сверхвысоким давлением, облучением, действием свободных радикалов или катализаторов. Так, полимеризация этилена происходит под действием кислот (катионный механизм) или радикалов (радикальный механизм):
n CH2=CH2 = -(-CH2-CH2-)n—
Примеры решения задач
| Задание | Установите молекулярную формулу алкена, если известно, что одно и тоже количество его, взаимодействуя с галогенами, образует, соответственно, или 56,5 г дихлорпроизводного или 101 г дибромпроизводного. |
| Решение | Химические свойства алкенов определяются их способностью присоединять вещества по механизму электрофильного присоединения, при этом двойная связь превращается в одинарную:
СnH2n + Cl2 → CnH2nCl2 CnH2n + Br2 → CnH2nBr2 Масса алкена, вступившего в реакцию одна и та же, значит в реакции участвует одинаковое количество моль алкена. Выразим количество моль углеводорода, если молярная масса дихлорпроизводного 12n+2n+71, молярная масса дибромпроизводного (12n+2n+160): m(CnH2nCl2) \ (12n+2n+71) = m(СnH2nBr2) \ (12n+2n+160) 56.5 \ (12n+2n+71) = 101 \ (12n+2n+160) n= 3, Следовательно, алкен имеет формулу C3H6 – это пропен. |
| Ответ | Формула алкена C3H6 – это пропен |
| Задание | Осуществите ряд превращений этан → этен → этанол → этен → хлорэтан → бутан |
| Решение | Для получения этена из этана необходимо использовать реакцию дегидрирования этана, которая протекает в присутствии катализатора (Ni, Pd, Pt) и при нагревании:
С2H6 →C2H4 + H2 Получение этанола из этена осуществляют по реакции гидратации, протекающей водой в присутствии минеральных кислот (серной, фосфорной): С2H4 + H2O = C2H5OH Для получения этена из этанола используют реакцию дегидротации: C2H5OH →(t, H2SO4) → C2H4 + H2O Получение хлорэтана из этена осуществляют по реакции гидрогалогенирования: С2H4 + HCl → C2H5Cl Для получения бутана из хлорэтана используют реакцию Вюрца: 2C2H5Cl +2Na → C4H10 + 2NaCl |











