Неметаллы: атомы и простые вещества. Кислород, озон, воздух
Электронная конфигурация валентных электронов неметаллов в общем виде — ns2np1−5 Исключение составляют водород (1s1) и гелий (1s2), которые тоже рассматривают как неметаллы.
Если в Периодической системе мысленно провести диагональ от бериллия к астату, то в правом верхнем углу таблицы будут находиться элементы-неметаллы. Среди неметаллов есть s-элемент – водород; р-элементы бор; углерод, кремний; азот, фосфор, мышьяк, кислород, сера, селен, теллур, галогены и астат. Элементы VIII группы – инертные (благородные) газы, которые имеют полностью завершенный внешний энергетический уровень и их нельзя отнести ни к металлам, ни к неметаллам.
Неметаллы обладают высокими значениями сродства к электрону , электроотрицательность и окислительно-восстановительный потенциал.
Характеристика атомов химических элементов — неметаллов
Неметаллы можно охарактеризовать в зависимости от строения их атомов, а также по их положению в Периодической системе Д.И. Менделеева. Рассмотрим характеристику химического элемента — неметалла на примере фосфора:
1. P – фосфор.
2. Порядковый номер – 15. Элемент находится в 3 периоде, в V группе, А (главной) подгруппе.
3. Z=15 (заряд ядра), M=31 (массовое число), e=15 (число электронов), p=15 (число протонов), n=31-15=16 (число нейтронов).
4. 15P 1s22s22p63s23p3 – электронная конфигурация, валентные электроны 3s23p 3.
5. Основное состояние
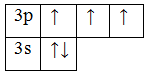
Возбужденное состояние
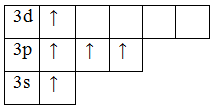
6. p-элемент, неметалл.
7. Высший оксид – P2O5 — проявляет кислотные свойства:
P2O5 + 3Na2O = 2Na3PO4
Гидроксид, соответствующий высшему оксиду – H3PO4, проявляет кислотные свойства:
H3PO4 + 3NaOH = Na3PO4 + 3H2O
8. Минимальная степень окисления «-3», максимальная – «+5»
Неметаллы – простые вещества
В свободном виде фтор, хлор, кислород, азот, водород и инертные газы представляют собой газообразные вещества, йод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор – твёрдые вещества; бром — жидкость.
Молекулы галогенов, кислорода и азота двухатомны: F2, Cl2, Br2, I2, O2, N2.
Кислород и озон
Кислород относится к семейству p-элементов. Электронная конфигурация атома кислорода 1s22s22p4. В своих соединениях кислород способен проявлять несколько степеней окисления: «-2», «-1» (в пероксидах), «+2» (F2O). Для характерно проявление явления аллотропии – существования в виде нескольких простых веществ – аллотропных модификаций. Аллотропные модификации кислорода – кислород O2 и озон O3.
В свободном состоянии кислород представляет собой газ без цвета и запаха, плохо растворимый в воде, озон – газ с резким запахом, неустойчив.
Различают промышленные и лабораторные способы получения кислорода. Так, в промышленности кислород получают перегонкой жидкого воздуха, а к основным лабораторным способам получения кислорода относят реакции термического разложения сложных веществ:
2KMnO4 = K2MnO4 + MnO2 + O2↑
4K2Cr2O7 = 4K2CrO4 + 2Cr2O3 +3O2↑
2KNO3 = 2KNO2 + O2↑
2KClO3=2KCl +3 O2↑
Во всех реакциях взаимодействия с простыми веществами, кроме фтора, кислород проявляет окислительные свойства:
4P + 5O2=2P2O5 (при нагревании)
P![]() -3e = P3+ — процесс окисления (восстановитель)
-3e = P3+ — процесс окисления (восстановитель)
O2![]() +2e = 2O2- — процесс восстановления (окислитель)
+2e = 2O2- — процесс восстановления (окислитель)
4Li + O2 =2Li2O (при н.у.)
Li![]() -e = Li+ — процесс окисления (восстановитель)
-e = Li+ — процесс окисления (восстановитель)
O2![]() +2e = 2O2- — процесс восстановления (окислитель)
+2e = 2O2- — процесс восстановления (окислитель)
При взаимодействии со сложными веществами происходит образование оксидов соответствующих элементов:
2H2S + O2 =2SO2 + 2H2O
Озон – более сильный окислитель, чем кислород. Получение озона осуществляют путем электрического разряда через кислород:
3O2↔2O3 – Q
Качественная реакция на озон – взаимодействие озона с иодидом калия (с кислородом эта реакция не идет):
2KI + O3 + H2O = I2 + 2KOH + O2
Выделяющийся в ходе реакции йод фиксируют по посинению крахмала.
Воздух
Воздух представляет собой смесь газов, растворенных друг в друге. В состав воздуха входят азот (78% по объему), кислород (21% по объему), благородные (инертные) газы (около 1% по объему), оксид углерода (IV), пары воды и различные примеси. Содержание оксида углерода (IV), паров воды и примесей в воздухе может меняться в зависимости от условий.
Диоксид углерода образуется в природе в результате процессов горения растительных материалов, при дыхании живых организмов и гниении. Большое количество CO2 поступает в атмосферу в результате деятельности человека. Несмотря на постоянное поступление CO2 в атмосферу среднее его содержание в воздухе практически всегда находится на уровне 0,03% по объему.
Содержание водных паров в воздухе колеблется от нескольких долей процента до нескольких процентов и определяется местными условиями и температурой.
Примеры решения задач
| Задание | Определите объем воздуха, необходимый для полного окисления сероводорода объемом 448 л. |
| Решение |
Окислительная способность воздуха обусловлена наличием в воздухе кислорода. Объемная доля кислорода в воздухе – 21%, т.е. 1/5 часть от всего объема воздуха. Запишем уравнение реакции полного окисления сероводорода кислородом воздуха:
2H2S + 3O2 =2SO2 +2H2O Найдем количество вещества сероводорода: v(H2S) = V(H2S)/Vm v(H2S) = 448/22,4 = 20 моль По уравнению число моль кислорода: v(O2)=1,5× v(H2S) v(O2)=1,5×20=30 моль Найдем объем кислорода: V(O2)= v(O2) × Vm V(O2)= 30 ×22,4 =672 л Тогда объем воздуха: V= V(O2) ×5 V= 672×5= 3360 л |
| Ответ | Объем воздуха — 3360 л |
| Задание | Охарактеризуйте кислород по его положению в Периодической системе химических элементов Д.И. Менделеева. |
| Ответ | 1. O – кислород.
2. Порядковый номер – 8. Элемент находится во 2 периоде, в VI группе, А (главной) подгруппе. 3. Z=88 (заряд ядра), M=16 (массовое число), e=8 (число электронов), p=8 (число протонов), n=16-8=8 (число нейтронов). 4. 8O 1s22s22p4 – электронная конфигурация, валентные электроны 2s22p4. 5. Основное состояние 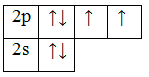
Возбужденного состояния нет 6. p-элемент, неметалл. 7. Минимальная степень окисления «-2», максимальная – «+2» |











