Химия и производство
Среди химических реакций, осуществляемых в лаборатории есть аналогичные, которые осуществляют в промышленных условиях для производства различной химической продукции (пластмассы, фармацевтические препараты, красители, удобрения, пестициды и различные химические вещества – серная, соляная и азотная кислоты, аммиак, этилен и др.).
Отрасли химической промышленности
Отрасль народного хозяйства, отвечающая за производство продукции на основе химической переработки сырья, называется химической промышленностью. Наиболее важные отрасли химической промышленности:
- неорганическая химия (производство аммиака, серной кислоты, соды)
- органическая химия (производство фенола, этилена, карбамида и т.д.)
- силикатная промышленность (производство керамики)
- нефтехимия (производство бензола, стирола)
- агрохимия (производство удобрений, пестицидов)
- производство полимеров (полиэтилен, полиэстер и др.) и эластомеров (резина, неопрен, полиуретаны)
- производство взрывчатых веществ (нитроглицерин, нитрат аммония)
- фармацевтика (производство лекарственных препаратов), производство парфюмерии и косметики (кумарин, ванилин, камфора)
Основа химической промышленности – химическая технология – наука о наиболее экономичных методах и средствах массовой химической переработки природных материалов (сырья) в продукты потребления и промежуточные продукты, применяемые в различных отраслях народного хозяйства.
Наиболее важными с точки зрения химической технологии считают производство аммиака и метанола. Эти вещества являются первостепенными звеньями, порождающими целые ряды новых производств. Так, из аммиака получают азотную кислоту (идет на производство удобрений, лекарств, красителей, пластмасс, искусственных волокон, взрывчатых веществ) или мочевину. После получения метанола возможно его использование в производства формальдегида, который, в свою очередь идет на производство фенол-формальдегидных смол и полиметилметакрилата.
Производство аммиака
Рассмотрим процесс производства аммиака (рис. 1), в основе которого лежит реакция:
N2 +3H2 ![]() 2NH3 + 92 кДж.
2NH3 + 92 кДж.
Поскольку реакция обратимая, а производство направлено на получение целевого продукта – аммиака, то необходимо подобрать оптимальные условия проведения синтеза исходя из характеристик химической реакции. Так, смещению равновесия в сторону образования аммиака будет способствовать повышенное давление.
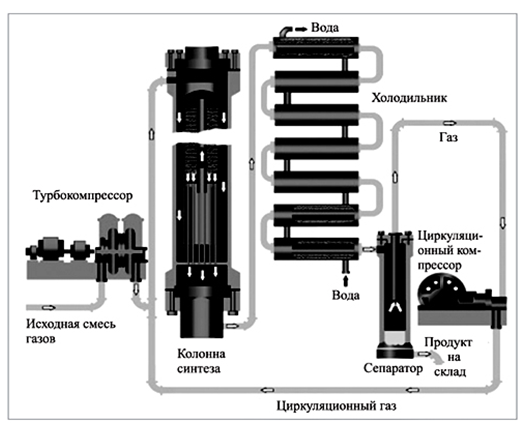
Рис. 1 Установка для получения аммиака в промышленных масштабах
Несмотря на то, что согласно принципу Ле-Шателье, для смещения равновесия в сторону продуктов при экзотермической реакции необходимо понизить температуру, реакцию проводят при оптимальной для данного процесса температуре: 450–500 °С, поскольку при понижении температуры скорость синтеза аммиака будет очень мала.
Для ускорения синтеза, используют катализатор, в роли которого выступает восстановленное железо, активированное оксидом калия или алюминия. Однако, при указанных выше условиях равновесный выход аммиака составляет не более 20%. Поэтому синтез осуществляется по способу многократной циркуляции, т. е. непрореагировавшую смесь газов многократно возвращают в производство после отделения от нее полученного продукта.
Производство анилина
В качестве широкомасштабного производства органических веществ рассмотрим производство анилина (рис. 2). Анилин (C6H5NH2) представляет собой простейший ароматический амин. Анилин используется для производства полиуретанов (сначала из анилина получают метилдиизоцианаты, а затем сами полиуретаны), искусственных каучуков, гербицидов красителей, взрывчатых веществ и лекарственных средств ( сульфаниламидные препараты ).
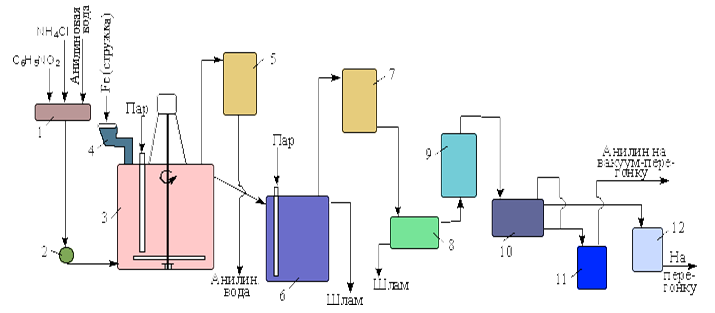
Рис. 2. Схема получения анилина путем непрерывного восстановления нитробензола чугунной стружкой: 1 — смеситель; 2— насос; 3—редуктор; 4 — шнековый питатель; 5, 7— конденсаторы; 6 — аппарат для отгонки анилина; 8 — отстойник шлама; 9 — холодильник; 10 — сепаратор; 11 — сборник сырого анилина; 12 — сборник анилиновой воды
Получение анилина осуществляют в две стадии. Сначала получают нитробензол по реакции нитрования бензола смесью концентрированной азотной и серной кислот при температуре 50—60 C, а затем осуществляют гидрирование нитробензола при температуре 200—300 °C в присутствии катализаторов, например железа:
4C6H5NO2 + 9Fe + 4H2O = 4C6H5NH2 + 3Fe3O4











