Строение атома висмута
Общие сведения о строении атома висмута
Относится к элементам p-семейства. Металл. Обозначение – Bi. Порядковый номер – 83. Относительная атомная масса – 208,98 а.е.м.
Электронное строение атома висмута
Атом висмута состоит из положительно заряженного ядра (+83), внутри которого есть 83 протона и 127 нейтронов, а вокруг, по шести орбитам движутся 83 электрона.
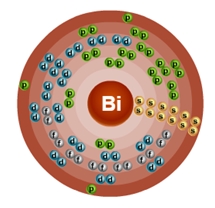
Рис.1. Схематическое строение атома висмута.
Распределение электронов по орбиталям выглядит следующим образом:
+83Bi)2)8)18)32)18)5;
1s22s22p63s23p63d104s24p64f145s25p65d106s26p3.
На внешнем электронном уровне атома висмута находится 5 электронов, которые являются валентными (расположены на 6s- и 6р- подуровнях). Энергетическая диаграмма основного состояния принимает следующий вид:
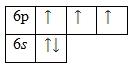
Наличие трех неспаренных электронов свидетельствует о том, что висмут может иметь степень окисления +3.
Валентные электроны атома висмута можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
|
Подуровень |
n |
l |
ml |
s |
|
s |
6 |
0 |
0 |
+1/2 |
|
s |
6 |
0 |
0 |
-1/2 |
|
p |
6 |
1 |
-1 |
+1/2 |
|
p |
6 |
1 |
0 |
+1/2 |
|
p |
6 |
1 |
+1 |
+1/2 |
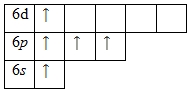
Для висмута характерно наличие возбужденного состояния за счет вакантных орбиталей 6d-подуровня (степень окисления +5):
Примеры решения задач
| Задание | Исходя из строения внешнего уровня атома меди, объясните, какие значения степени окисления могут быть характерны для меди. |
| Решение | Напишем электронную формулу атома меди в основном состоянии, учитывая, что для меди характерен проскок электрона с 4s –подуровня на 3d-подуровень, который объясняется тем, что завершенный подуровень энергетически более выгоден:
1s22s22p63s23p63d104s1. 4s-электрон является валентным. В возбужденном состоянии один из d-электронов возвращается на 4-й уровень, таким образом там оказывается 2 валентных электрона. Итак, для меди характерны два значения степени окисления: +1 и +2. |
| Ответ | Для меди характерны два значения степени окисления: +1 и +2. |
| Задание | Запишите электронные конфигурации атомов элементов с атомными номерами 7, 16, 21. |
| Ответ | Химический элемент с атомным номером 7 – это азот. Он находится во втором периоде, следовательно, имеет две орбитали. Расположение азота в V группе Периодической таблицы свидетельствует о наличии на внешнем энергетическом уровне 5-ти валентных электронов:
+7 N)2)5; 1s22s22p3. Химический элемент с атомным номером 16 – это сера. Она находится в третьем периоде, следовательно, имеет три орбитали. Расположение серы в VIгруппе Периодической таблицы свидетельствует о наличии на внешнем энергетическом уровне 6-ти валентных электронов: +16 S)2)8)6; 1s22s22p63s23p4. Химический элемент с атомным номером 21 – это скандий. Он находится в четвертом периоде, следовательно, имеет четыре орбитали. Расположение скандия в III группе Периодической таблицы свидетельствует о наличии на внешнем энергетическом уровне 3-х валентных электронов: +21 Sc)2)8)8)3; 1s22s22p63s23p63d24s2. |











