Строение атома углерода
Общие сведения о строении атома углерода
Порядковый номер равен 6. Заряд ядра равен +6. Атомный вес – 12,001 а.е.м. Известен изотоп углерода с массовым числом 14 (14С).
Электронное строение атома углерода
Атом углерода имеет две оболочки, как и все элементы, расположенные во втором периоде. Номер группы – IV – свидетельствует о том, что на внешнем электронном уровне атома углерода находится 4 валентных электрона.
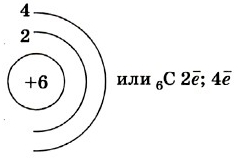
Рис. 1. Схематичное строение атома углерода.
Электронная конфигурация основного состояния записывается следующим образом:
+6 C)2)4;
1s22s22p2.
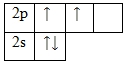
Углерод – элемент p-семейства. Энергетическая диаграмма для валентных электронов в невозбужденном состоянии выглядит следующим образом:
Поскольку в атоме углерода имеется ещё одна вакантная p-орбиталь, то для него возможно возбужденное состояние (один из электронов 2s-уровня переходит на свободный p-подуровень):
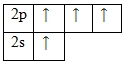
Количество неспаренных электронов характеризует валентность химического элемента. Таким образом, в своих соединениях углерод проявляет валентность II или IV.
Рис. 2. Пространственное изображение строения атома углерода.
Примеры решения задач
| Задание | Запишите электронные конфигурации следующих ионов: Ca2+, S2-, N3-, F— и Na+. |
| Ответ | Для того, чтобы образовать положительно заряженный ион, атом отдает валентные электроны и, наоборот, принимает их, чтобы образовался отрицательно заряженный ион. Тогда электронные конфигурации ионов будут иметь следующий вид:
20Ca2+ 1s22s22p63s23p64s0; 16S2- 1s22s23s23p6; 7N3- 1s22s22p6; 9F— 1s22s22p6; 11N+ 1s22s22p63s0. |
| Задание | Как изменятся электронные конфигурации при превращении атомов в ионы:
а) Al → Al3+; б) Cl → Cl—; в) Sc → Sc3+; г) Br → Вr—? |
| Ответ | Для того, чтобы образовать положительно заряженный ион, атом отдает валентные электроны и, наоборот, принимает их, чтобы образовался отрицательно заряженный ион.
а) 13Al1s22s22p63s23p1 13Al3+ 1s22s22p63s03p0 б) 17Cl 1s22s22p63s23p5 17Cl—1s22s22p63s23p6 в) 21Sc 1s22s22p63s23p63d34s2 21Sc3+1s22s22p63s23p63d04s2 г) 35Br 1s22s22p63s23p63d104s24p5 35Вr—1s22s22p63s23p63d104s24p6 |











