Строение атома рутения
Общие сведения о строении атома рутения
Относится к элементам d-семейства. Металл. Обозначение – Ru. Порядковый номер – 44. Относительная атомная масса – 101,07 а.е.м.
Электронное строение атома рутения
Атом рутения состоит из положительно заряженного ядра (+44), внутри которого есть 44 протона и 57 нейтронов, а вокруг, по пяти орбитам движутся 44 электрона.
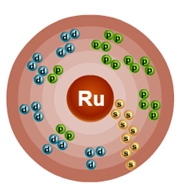
Рис.1. Схематическое строение атома рутения.
Распределение электронов по орбиталям выглядит следующим образом:
+44Ru)2)8)18)15)1;
1s22s22p63s23p63d104s24p64d75s1.
Валентными электронами атома рутения считаются электроны, расположенные на 4d— и 5s-орбиталях. Энергетическая диаграмма основного состояния принимает следующий вид:
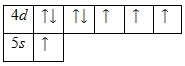
Валентные электроны атома рутения можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
|
Подуровень |
n |
l |
ml |
s |
|
s |
5 |
0 |
0 |
+1/2 |
|
d |
4 |
2 |
-2 |
+1/2 |
|
d |
4 |
2 |
-1 |
+1/2 |
|
d |
4 |
2 |
0 |
+1/2 |
|
d |
4 |
2 |
+1 |
+1/2 |
|
d |
4 |
2 |
+2 |
+1/2 |
|
d |
4 |
2 |
-2 |
-1/2 |
|
d |
4 |
2 |
-1 |
-1/2 |
Примеры решения задач
| Задание | Сколько атомных орбиталей f-подуровня заполнено у элементов с порядковыми номерами 59 и 65? Запишите их электронные формулы. |
| Решение | На f-подуровне имеется семь орбиталей, на каждой из которых может одновременно находиться 2 электрона (14 в сумме). Элементы с порядковыми номерами 59 и 65 – это празеозим (Pr) и тербий (Tb). Запишем электронные формулы их атомов в основном состоянии:
59Pr 1s 22s 22p 63s 23p63d104s 24p64d104f35s25p66s2; 65Tb 1s 22s 22p 63s 23p63d104s 24p64d104f95s25p66s2. В атоме празеодима заполнено 3 орбитали на f-подуровне, а в атоме тербия – все, но не полностью. |
| Ответ | 3 и 7. |
| Задание | У какого из р–элементов пятой группы периодической системы – фосфора или сурьмы – сильнее выражены неметаллические свойства? Ответ обоснуйте исходя из строения атомов данных элементов. Запишите их электронные формулы. |
| Ответ | Запишем электронные конфигурации фосфора и сурьмы в основном состоянии:
15P 1s 22s 22p 63s 23p3; 51Sb 1s 22s 22p 63s 23p63d104s 24p64d104f95s25p3. Неметаллические свойства у фосфора выражены сильнее, чем у сурьмы, поскольку атом фосфора имеет 3 электронные оболочки, а сурьма 5, вследствие чего её валентные электроны слабее удерживаются ядром и она легче отдает их другому атому при химическом взаимодействии. |











