Строение атома криптона
Общие сведения о строении атома криптона
Обозначение – Kr. Относится к семейству p-элементов. Порядковый номер равен 36. Атомный вес – 83,8 а.е.м.
Электронное строение атома криптона
Атом криптона состоит из положительно заряженного ядра (+36), состоящего из 36 протонов и 48 нейтронов, вокруг которого по 4-м орбитам движутся 36 электронов.
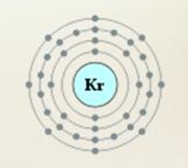
Рис.1. Схематическое строение атома криптона.
Распределение электронов по орбиталям выглядит следующим образом:
+36 Kr)2)8)18)8;
1s22s22p63s23p63d104s24p6.
Внешний энергетический уровень атома криптона полностью завершен – 8 электронов. Энергетическая диаграмма основного состояния принимает следующий вид:
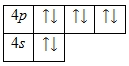
Возбужденного состояния, несмотря на наличие вакантных 4d— и 4f-орбиталей нет.Именно поэтому криптон относят к инертным газам. Химически он малоактивен.
Примеры решения задач
| Задание | Чем отличается электронное облако, которое характеризуется квантовыми числами n=4, l =0, m=0, от электронного облака, которое характеризуется квантовыми числами n=3, l =0, m=0 ? |
| Ответ | Электронное облако, характеризующееся набором квантовых чисел n=4, l =0, m=0 – это 4s— орбиталь. А электронное облако с набором n=3, l =0, m=0 – это 3s-орбиталь. Они различаются по своей энергии. Энергия 3s-орбитали ниже, чем 4s— орбитали, поэтому она заполняется электронами в первую очередь. |
| Задание | Какие значения имеют орбитальные квантовые числа для энергетических подуровней, емкость которых равна 2, 6, 10, 14? |
| Ответ | Подуровни, максимальная энергетическая емкость которых равна 2, 6, 10, 14 по-другому называются s-, p-, d— и f-орбиталями. Орбитальные квантовые числа для них равны 0, 1, 2 и 3, соответственно. |











