Строение атома фтора
Общие сведения о строении атома фтора
Порядковый номер равен 9. Заряд ядра равен +9. Атомный вес – 18,998 а.е.м. Это единственный стабильный нуклид фтора.
Электронное строение атома фтора
Атом фтора имеет две оболочки, как и все элементы, расположенные во втором периоде. Номер группы – VII (галогены) – свидетельствует о том, что на внешнем электронном уровне атома азота находится 7 валентных электронов и до завершения внешнего энергетического уровня не хватает всего одного электрона. Обладает самой высокой окислительной способностью среди всех элементов Периодической системы.
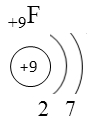
Рис. 1. Условное изображение строения атома фтора.
Электронная конфигурация основного состояния записывается следующим образом:
1s22s22p5.
Фтор – элемент p-семейства. Энергетическая диаграмма для валентных электронов в невозбужденном состоянии выглядит следующим образом:
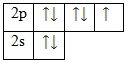
У фтора есть 3 пары спаренных электронов и один неспаренный электрон. Во всех своих соединениях фтор проявляет валентность I и степень окисления -1.
В результате взаимодействия фтор является акцептором электронов. В этом случае атом превращается в отрицательно заряженный ион (F—):
F0 +e →F—.
Примеры решения задач
| Задание | Определите емкость подуровня, для которого магнитное квантовое число принимает пять значений. |
| Решение | Пять значений принимает магнитное квантовое число для d-подуровня. Емкость подуровня – это максимальное число электронов на подуровне. Число орбиталей на подуровне определяется по формуле:
2l + 1, где l – орбитальное квантовое число. На каждой орбитали могут находиться два электрона. Для d-подуровня l=2, поэтому емкость d-подуровня равна: 2×(2×2+1) = 10. Следовательно, d-подуровень максимально вмещает 10 электронов. |
| Ответ | 10 электронов. |
| Задание | Охарактеризуйте квантовыми числами все электроны, которые находятся на 3p-подуровне. |
| Решение | На p-подуровне 3-го уровня находится шесть электронов:
3p6 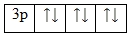
Их можно охарактеризовать следующими квантовыми числами: n=3; l=1; m= -1; 0; +1; s= +1/2; -1/2. |
| Ответ | n=3; l=1; m= -1; 0; +1; s= +1/2; -1/2. |











