Строение алкенов и их особенности
Общие сведения о строении алкенов
Эти соединения подчиняются общей формуле CnH2n, а в их названии присутствует суффикс –ен. Гомологический ряд алкенов начинается с этилена (этен) C2H6.
По сравнению с алканами, алкены характеризуются более низкими температурами плавления и кипения. Внутри гомологического ряда эти физические величины возрастают. Алкены, имеющие в своем составе от 2-х до 4-х атомов углерода представляют собой газы, от 5-ти до 17-ти – жидкости, более 17-ти – твердые вещества.
Электронное строение алкенов и их особенности
Рассмотрим строение алкенов на примере первого представителя их гомологического ряда – молекуле этилена, структурная формула которого выглядит следующим образом:
CH2 = CH2.
Если в алканах атомы углерода были связаны между собой только посредством одинарных σ-связей, то с появлением кратной двойной связи в молекулах алкенов наблюдается образование π-связи.
Атомы углерода, связанные двойной связью в алкенах находятся в sp2-гибридизации. Для того, чтобы объяснить это явление запишем электронные конфигурации атомов углерода и водорода в основном состоянии:
6C1s22s22p2;
1H 1s1.
И зарисуем их электронно-графические формулы:
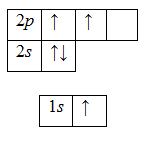
Наличие двух неспаренных электронов в атоме углерода свидетельствует о том, что в основном состоянии он может образовать только две химические связи, поэтому углерод переходит в возбужденное состояние (электроны 2s-подуровня распариваются и один из них занимает вакантную орбиталь 2p-подуровня):
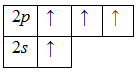
Из этого следует, что один электрон идет на образование σ-связи с соседним атомом углерода, два — на образование σ-связей с атомами водорода, а четвертый – на образование π-связи (рис. 1)
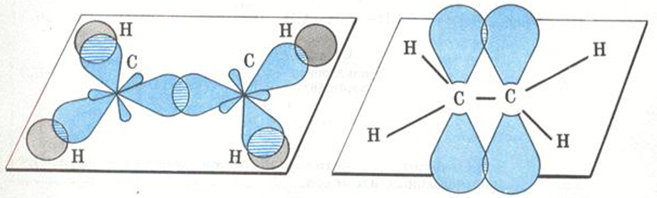
Рис. 1. Образование двойной связи на примере молекулы этилена.
Длина двойной связи С=С несколько меньше, чем одинарной (0,133 нм, против 0,154 нм), равно как и её энергия 606 кДж/моль против 694 кДж/моль), что связано с меньшей энергией π-связи.
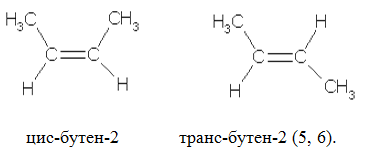
Для алкенов, также как и для алканов, характерно явление изомерии. Однако, помимо изомерии углеродного скелета (1, 2) им свойственна изомерия положения кратной связи (3, 4) и пространственная (цис-транс-) изомерия (5, 6):
CH2 = CH – CH2 – CH3 (бутен -1) (1);
CH2 = C(CH3) – CH3 (2-метилпропен -1) (2);
CH2 = CH – CH2 – CH2 — CH3 (пентен -1) (3);
CH3— CH = CH – CH2 — CH3 (пентен -2) (4);
Примеры решения задач
| Задание | Установите молекулярную формулу алкена, если известно, что одно и тоже количество его, взаимодействуя с галогенами, образует, соответственно, или 56,5 г дихлорпроизводного или 101 г дибромпроизводного. |
| Решение | Химические свойства алкенов определяются их способностью присоединять вещества по механизму электрофильного присоединения, при этом двойная связь превращается в одинарную:
СnH2n + Cl2 → CnH2nCl2; CnH2n + Br2 → CnH2nBr2. Масса алкена, вступившего в реакцию одна и та же, значит в реакции участвует одинаковое количество моль алкена. Выразим количество моль углеводорода, если молярная масса дихлорпроизводного 12n+2n+71, молярная масса дибромпроизводного (12n+2n+160): m(CnH2nCl2) \ (12n+2n+71) = m(СnH2nBr2) \ (12n+2n+160); 56.5 \ (12n+2n+71) = 101 \ (12n+2n+160); n= 3. Следовательно, алкен имеет формулу C3H6. Это пропен. |
| Ответ | Формула алкена C3H6. Это пропен. |
| Задание | Осуществите ряд превращений:
этан → этен → этанол → этен → хлорэтан → бутан. |
|
| Решение | Для получения этена из этана необходимо использовать реакцию дегидрирования этана, которая протекает в присутствии катализатора (Ni, Pd, Pt) и при нагревании:
C2H6 →C2H4 + H2. Получение этанола из этена осуществляют по реакции гидратации, протекающей водой в присутствии минеральных кислот (серной, фосфорной): C2H4 + H2O = C2H5OH. Для получения этена из этанола используют реакцию дегидротации: C2H5OH →(t, H2SO4) → C2H4 + H2O. Получение хлорэтана из этена осуществляют по реакции гидрогалогенирования: C2H4 + HCl → C2H5Cl. Для получения бутана из хлорэтана используют реакцию Вюрца: 2C2H5Cl +2Na → C4H10 + 2NaCl. |











