Состояние электронов в атоме
Электронное строение атома и энергия электронов
Электронное строение атома определяется энергией электронов, а также вероятностью их нахождения в каждой точке пространства вблизи ядра. Поведение электронов в атоме описывается с помощью квантовой механики, главный постулат которой – все микрочастицы имеют волновую природу, а волны – свойства частиц (корпускулярно – волновой дуализм).
Масса (m) любой частицы и ее скорость (v) связаны с длиной волны (λ) уравнением де Бройля:
λ=h / m × v,
где h – постоянная Планка (6,62 × 10-34 Дж × с).
Второй постулат квантовой механики говорит о том, что невозможно одновременно точно определить положение и импульс электрона (принцип неопределенности Гейзенберга). Погрешности в определении координаты (Δx) и импульса (Δmv) связаны соотношением:
Δx × Δmv ≥ ![]() = 1,05 × 10-34 Дж × с
= 1,05 × 10-34 Дж × с
В-третьих, энергия электронов меняется квантами (порциями).
Поскольку квантовая механика рассматривает вероятность нахождения электрона в пространстве вокруг ядра, а быстродвижущийся электрон может находиться в любой области пространства, то если бы удалось сфотографировать через малые промежутки времени положение электрона в атоме и наложить полученные снимки друг на друга, то получилась бы картина электронного облака.
Электронное облако — квантовомеханическая модель, описывающая состояние электрона в атоме. Плотность электронного облака неравномерна (рис. 1). Пространство, вокруг ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью. В нем заключено 90% электронного облака.
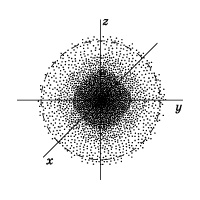
Рис. 1. Электронное облако атома водорода с неравномерной плоностью.
Располагаясь на азличных расстояниях от ядра электроны образуют энергетические слои (энергетические уровни). Их нумеруют, начиная от ядра: 1, 2, 3, 4, 5, 6, 7 или обозначают буквами: K, L, M, N, O, P, Q.
Квантовые числа
Состояние электрона в атоме можно описать с помощью четырех квантовых чисел (табл. 1). Целое число n, обозначающее номер уровня, называют главным квантовым числом. Оно характеризует энергию электронов, которые занимают конкретный энергетический уровень. Наименьшая энергия характерна для электронов, максимально близко расположенных к ядру. Число энергетических уровней в атоме определяется номером периода, в котором находится элемент. Наибольшее число электронов на энергетическом уровне можно определить по формуле:
N = 2n2,
где N – число электронов, n – главное квантовое число.
Таблица 1. Квантовые числа, характеризующие состояние электрона в атоме
|
Квантовое число |
Принимаемые значения |
Характеризуемое свойство |
Примечание |
|
Главное (n) |
1,2,3,… , ∞ |
Энергия уровня, среднее расстояние от ядра |
n=∞ — нет взаимодействия с ядром |
|
Орбитальное (l) |
0, 1,… , (n-1) |
Орбитальный момент количества движения – форма орбитали |
Обычно используют буквенные символы: 0 (s), 1 (p), 2 (d), 3 (f) |
|
Магнитное (ml) |
-l,… , 0,… , +l |
Ориентация момента количества движения – расположение орбитали в пространстве |
При помещении в магнитное поле, орбитали с различным ml имеют различную энергию |
|
Спиновое (ms) |
|
Ориентация собственного магнитного момента |
Обозначают ↑ или↓ |
Состояние электронов в атомах определяется принципом Паули: в атоме не может быть двух электронов с одинаковым набором всех квантовых чисел. Последовательность заполнения орбиталей электронами определяется правилами Клечковского: орбитали заполняются электронами в порядке возрастания суммы (n+l) для этих орбиталей, если сумма (n+l) одинакова, то первой заполняется орбиталь с меньшим значением n.
Электронная формула
Строение электронной оболочки изображается электронной формулой, которая показывает распределение электронов по энергетическим уровням и подуровням. Число электронов на подуровне обозначается цифрой, которая записывается справа вверху от буквы, показывающей подуровень. Например, атом водорода имеет один электрон, который расположен на s-подуровне 1-го энергетического уровня: 1s1. Электронная формула гелия, содержащего два электрона записывается так: 1s2.
У элементов второго периода электроны заполняют 2-й энергетический уровень, на котором могут находиться не более 8-ми электронов. Вначале электроны заполняют s-подуровень, потом – p-подуровень. Например:
3Li 1s22s1
5B 1s22s22p1
У атомов некоторых элементов, наблюдается явление «проскока» электрона с внешнего энергетического уровня на предпоследний. Проскок электрона происходит у атомов меди, хрома, палладия и некоторых других элементов. Например:
24Cr 1s22s22p63s23p63d54s1
Задания:
1. Написать электронные формулы атомов элементов с порядковыми номерами: 23, 27, 29.
2. Атомы элементов имеют следующие электронные формулы: 1s22s22p4 и 1s22s22p63s 23p63d54s1. Определить порядковый номер элемента, а также семейство и группу, к которым они относятся.
Ответы :
1. 23Ti 1s22s22p63s23p63d34s2
27Co 1s22s22p63s23p63d74s2
29Cu 1s22s22p63s23p63d104s1
2. Суммарное число электронов на всех подуровнях равно порядковому номеру элемента. В первом случае число электронов равно 8, следовательно, это кислород, он находится в VI группе, главной подгруппе и относится к семейству p-элементов. Во втором случае сумма электронов равна 24, значит это хром, он находится в в VI группе, побочной подгруппе и относится к семейству d-элементов.











