Почему протекают химические реакции?
Основные понятия химической термодинамики
Химические процессы могут протекать с изменением химического состава вещества (химические реакции) и без его изменения (фазовые переходы). Совокупность веществ, находящихся во взаимодействии и выделенных из окружающего пространства (мысленно) называется системой. Например: атом водорода (система из ядра и электрона), водный раствор различных солей и т.д.
В зависимости от характера взаимодействия системы с окружающей средой различают: открытые или незамкнутые (происходит обмен теплом, энергией и веществом с окружающей средой), закрытые или замкнутые (происходит обмен теплом и энергией с окружающей средой, но нет обмена веществом) и изолированные (отсутствие массо- и теплопереноса между системой и окружающей средой) (рис. 1).
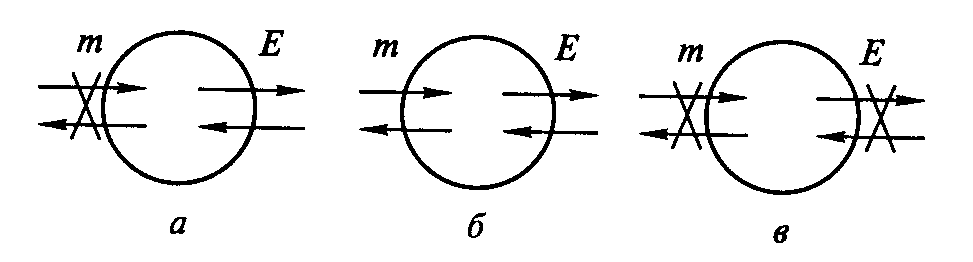
Рис. 1. Примеры закрытой (а), открытой (б) и изолированной систем (в).
Состояние системы определяется совокупностью ее свойств и характеризуется термодинамическими параметрами температурой, давлением и объемом (T, p, V). Любое изменение одного или нескольких параметров системы называется термодинамическим процессом. Так, повышение температуры приводит к изменению внутренней энергии системы (U).
Нельзя рассчитать или измерить абсолютное значение U. Возможно определить изменение внутренней энергии (ΔU) в результате какого-либо процесса. ΔU любой системы при переходе из одного состояния в другое не зависит от пути перехода, а определяется начальным и конечным положениями системы. Это означает, что внутренняя энергия системы — функция состояния.
ΔU = U2 – U1,
Где 1 и 2 – символы начального и конечного состояния системы.
Первое начало термодинамики: сообщенное системе тепло Q расходуется на приращение внутренней энергии и на совершение работы (А) против внешних сил:
Q = ΔU + A
Следует отметить, что А и Q не являются функциями состояния, т.е. не зависят от пути протекания процесса.
В термодинамике нередко вводят величины, которые тождественны сумме нескольких термодинамических параметров. Такая замена существенно облегчает расчеты. Так, функцию состояния, равную U + pV, называют энтальпией (Н):
H = U +pV
При постоянном давлении (изобарный процесс) и в отсутствии других работ, кроме работы расширения, теплота равна изменению энтальпии:
Qp = ΔU + pΔV = ΔH
Если процесс идет при постоянном объеме (изохорный) и в отсутствие других работ, выделившаяся или поглотившаяся теплота соответствует изменению внутренней энергии:
QV = ΔU
Основы термохимии
Раздел химической термодинамики, изучающий теплоты химических реакций и их зависимость от различных физико-химических параметров, называют термохимией. В термохимии пользуются термохимическими уравнениями реакций, в которых указывают агрегатное состояние вещества, а тепловой эффект реакции рассматривается как один из продуктов. Например:
2H2(g) + O2(g) = H2O(g) + 242 кДж,
Что означает, что при образовании 1 моль воды в газообразном состоянии выделяется 242 кДж тепла. При этом изменение энтальпии ΔH = − 242 кДж.
Противоположные знаки Q и ΔH свидетельствуют о том, что в первом случае – это характеристика процессов в окружающей среде, а во втором – в системе. При экзотермическом процессе Q > 0, ΔH < 0, а при эндотермическом – наоборот.
Тепловые эффекты можно не только измерять, но и рассчитывать с помощью закона Гесса: тепловой эффект химической реакции, протекающей при постоянных p и V не зависит от числа промежуточных стадий, а определяется лишь начальным и конечным состоянием системы.
Следствия закона Гесса
Из закона Гесса есть 5 следствий:
1) Тепловой эффект образования 1 моль сложного вещества из простых веществ, при стандартный условиях, называется теплотой образования этого вещества – ΔH0f. Так, например, ΔH0f (CO2) из С(s) и O2(g ) будет равен −393,51 кДж.
2) Стандартные теплоты образования простых веществ равны нулю.
3) Стандартный тепловой эффект химической реакции (ΔH0) равен разности между суммой теплот образования продуктов реакции (с учетом стехиометрических коэффициентов) и суммой теплот образования исходных веществ (с учетом стехиометрических коэффициентов):
ΔH0 = Σ ΔH0f (продукты) − Σ ΔH0f (реагенты)
Например, для реакции:
2H2S(g) + 3O2(g) = 2SO2(g) + 2H2O(aq)
ΔH0 = Σ (2 × ΔH0f (SO2) + 2 × ΔH0f (H2O)) – Σ (2 ΔH0f (H2S) +0)
4) Тепловой эффект химической реакции равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции с учетом стехиометрических коэффициентов
5) С термохимическими уравнениями можно производить все алгебраические действия, например:
A= B + C + 400 кДж
B + D = A − 200 кДж
Сложив эти уравнения получим
A + B + D = B + C + A + 200 кДж
D = C + 200 кДж
ΔH0 = − 200 кДж
Энтропия. Направление химических процессов. Энергия Гиббса
ΔS = Q/T
Например, при испарении воды в условиях кипения (Т =373 К, р=1 атм) изменение энтропии равно ΔS = ΔHисп/373 = 44000/373 = 118 кДж/(моль × К).
На основании о стандартной энтропии веществ (S0) можно рассчитать изменение энтропии различный процессов:
ΔrS0 = Σ niS0 − Σ njS0,
где i – продукты реакции, j – исходные вещества.
Энтропия простых веществ не равна нулю.
Рассчитав ΔrS0 и ΔrH0 можно сделать вывод об обратимости реакции. Так, если ΔrS0 и Δ rH0 больше нуля или ΔrS0 и ΔrH0 меньше нуля, то реакция носит обратимый характер.
Существует функция, которая связывает изменение энтальпии и энтропии и отвечает на вопрос о самопроизвольности протекания реакции – энергия Гиббса (G).
ΔG = ΔH − Т × ΔS
ΔrG0 = ΔrH0 − Т × ΔrS0
О направлении протекания химической реакции судят по величине ΔrG0. Если ΔrG0<0, то реакция идет в прямом направлении, а если ΔrG0 > 0 – в обратном. С наибольшей вероятностью из 2х реакций будет протекать та, у которой меньше значение Δ rG0.
Таблица 1. Условия самопроизвольности протекания химических реакций
|
Знаки |
Возможность самопроизвольного протекания реакции |
Примеры |
||
|
ΔH |
ΔS |
ΔG |
||
|
− |
+ |
− |
При любой Т |
2C6H6(aq)+15O2(g)=12CO2(g)+ 6H2O(g) |
|
+ |
− |
+ |
Термодинамически невозможна. Может идти в обратном направлении |
N2(g) + 2O2(g) = 2NO2(g) |
|
− |
− |
± |
При низких Т |
N2(g) + 3H2(g) = 2NH3(g) |
|
+ |
+ |
± |
При высоких Т |
N2O4(g) = 2NO2(g) |
Примеры решения задач
| Задание | Рассчитайте ΔHo298 химической реакции Na2O(т) + H2O(ж) → 2NaOH(т), если стандартные теплоты образования (ΔHof) Na2O(т), H2O(ж) и NaOH(т) при 298К равны соответственно –416, –286 и –427,8 кДж/моль. |
| Решение | Используя следствие из закона Гесса, рассчитываем ΔHo298 химической реакции:
ΔHo298= 2 ΔHof (NaOH,т) – [ΔHof (Na2O,т) +Δ Hof (H2O,ж)] ΔHo298 = 2·(– 427,8) – [–416 + (–286)] = −153,6 кДж. |
| Ответ | ΔHo298 = −153,6 кДж |
| Задание | Рассчитайте изменение энергии Гиббса (ΔGo298) для процесса:
Na2O(т) + H2O(ж) → 2NaOH(т) Возможно ли самопроизвольное протекание реакции при стандартных условиях и 298К ? Необходимые справочные данные: ΔGof (NaOH,т) = –381,1 кДж/моль, ΔGof (Na2O) = –378 кДж/моль, Δ Gof (H2O,ж) = –237 кДж/моль. |
| Решение | При стандартных условиях и
T=298К ΔGo298 можно рассчитать как разность суммарной энергии Гиббса (ΔG of ) образования продуктов реакции и суммарной энергии Гиббса образования исходных веществ:
ΔGo298 = 2ΔGof (NaOH,т) – [ΔGof (Na2O,т) + Δ Gof (H2O,ж)] ΔGo298 = 2(–381,1) –[–378 + (–237)] = –147,2 кДж. Значение ΔGo298 отрицательно, поэтому самопроизвольное протекание реакции возможно. |
| Ответ | ΔGo298 = –147,2 кДж, самопроизвольное протекание реакции возможно. |











