Периодический закон, периодическая система химических элементов Менделеева и строение атома
Периодический закон
Д.И. Менделеев сформулировал Периодический закон в 1869 году, в основе которого была одна из главнейших характеристик атома – атомная масса. Последующее развитие Периодического закона, а именно, получение большого экспериментальных данных, несколько изменило первоначальную формулировку закона, однако эти изменения не противоречат главному смыслу, заложенному Д.И. Менделеевым. Эти изменения только придали закону и Периодической системе научную обоснованность и подтверждение правильности.
Современная формулировка Периодического закона Д.И. Менделеева такова: свойства химических элементов, а также свойства и формы соединений элементов находятся в периодической зависимости от величины заряда ядер их атомов.
Структура Периодической системы химических элементов Д.И. Менделеева
К настоящему мнению известно большое количество интерпретаций Периодической системы, но наиболее популярная – с короткими (малыми) и длинными (большими) периодами. Горизонтальные ряды называют периодами (в них расположены элементы с последовательным заполнением одинакового энергетического уровня), а вертикальные столбцы – группами (в них расположены элементы, имеющие одинаковое количество валентных электронов – химические аналоги). Так же все элементы можно разделить на блоки по по типу внешней (валентной) орбитали: s-, p-, d-, f-элементы.
Всего в системе (таблице) 7 периодов, причем номер периода (обозначается арабской цифрой) равен числу электронных слоев в атоме элемента, номеру внешнего (валентного) энергетического уровня, значению главного квантового числа для высшего энергетического уровня. Каждый период (кроме первого) начинается s-элементом — активным щелочным металлом и заканчивается инертным газом, перед которым стоит p-элемент — активный неметалл (галоген). Если продвигаться по периоду слева направо, то с ростом заряда ядер атомов химических элементов малых периодов будет возрастать число электронов на внешнем энергетическом уровне, вследствие чего свойства элементов изменяются – от типично металлических (т.к. в начале периода стоит активный щелочной металл), через амфотерные (элемент проявляет свойства и металлов и неметаллов) до неметаллических (активный неметалл – галоген в конце периода), т.е. металлические свойства постепенно ослабевают и усиливаются неметаллические.
В больших периодах с ростом заряда ядер заполнение электронов происходит сложнее, что объясняет более сложное изменение свойств элементов по сравнению с элементами малых периодов. Так, в четных рядах больших периодов с ростом заряда ядра число электронов на внешнем энергетическом уровне остается постоянным и равным 2 или 1. Поэтому, пока идет заполнение электронами следующего за внешним (второго снаружи) уровня, свойства элементов в четных рядах изменяются медленно. При переходе к нечетным рядам, с ростом величины заряда ядра увеличивается число электронов на внешнем энергетическом уровне (от 1 до 8), свойства элементов изменяются также, как в малых периодах.
Вертикальные столбцы в Периодической системе – группы элементов со сходным электронным строением и являющимися химическими аналогами. Группы обозначают римскими цифрами от I до VIII. Выделяют главные (А) и побочные (B) подгруппы, первые из которых содержат s- и p-элементы, вторые – d – элементы.
Номер А подгруппы показывает число электронов на внешнем энергетическом уровне (число валентных электронов). Для элементов В-подгрупп нет прямой связи между номером группы и числом электронов на внешнем энергетическом уровне. В А-подгруппах металлические свойства элементов усиливаются, а неметаллические – уменьшаются с возрастанием заряда ядра атома элемента.
Между положением элементов в Периодической системе и строением их атомов существует взаимосвязь:
— атомы всех элементов одного периода имеют равное число энергетических уровней, частично или полностью заполненных электронами;
— атомы всех элементов А подгрупп имею равное число электронов на внешнем энергетическом уровне.
Периодические свойства элементов
Близость физико-химических и химических свойств атомов обусловлена сходством их электронных конфигураций, причем, главную роль играет распределение электронов по внешней атомной орбитали. Это проявляется в периодическом появлении, по мере увеличения заряда ядра атома, элементов с близкими свойствами. Такие свойства называют периодическими, среди которых наиболее важными являются:
1. Количество электронов на внешней электронной оболочке (заселенность – w). В малых периодах с ростом заряда ядра w внешней электронной оболочки монотонно увеличивается от 1 до 2 (1 период), от 1 до 8 (2-й и 3-й периоды). В больших периодах на протяжении первых 12 элементов w не превышает 2, а затем монотонно увеличивается до 8.
2. Атомный и ионный радиусы (r), определяемые как средние радиусы атома или иона, находимые из экспериментальных данных по межатомным расстояниям в разных соединениях. По периоду атомный радиус уменьшается (постепенно прибавляющиеся электроны описываются орбиталями с почти равными характеристиками, по группе атомный радиус возрастает, поскольку увеличивается число электронных слоев (рис.1.).
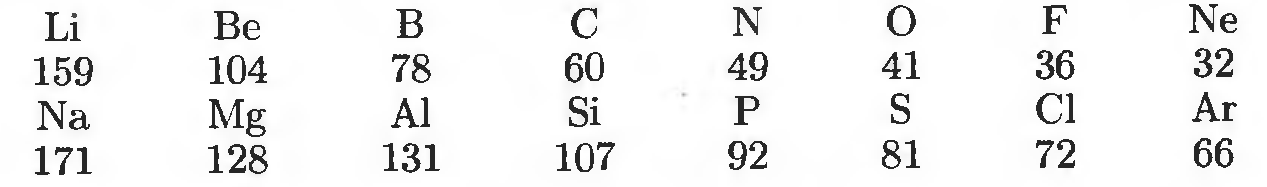
Рис. 1. Периодическое изменение атомного радиуса
Такие же закономерности наблюдаются и для ионного радиуса. Следует заметить, что ионный радиус катиона (положительно заряженный ион) больше атомного радиуса, а тот в свою очередь, больше ионного радиуса аниона (отрицательно заряженный ион).
3. Энергия ионизации (Еи) – количество энергии, необходимое для отрыва электрона от атома, т.е. энергия, необходимая для превращения нейтрального атома в положительно заряженный ион (катион).
Э0 — ![]() → Э+ + Еи
→ Э+ + Еи
Еи измеряется в электронвольтах (эВ) на атом. В пределах группы Периодической системы значения энергии ионизации атомов уменьшаются с возрастанием зарядов ядер атомов элементов. От атомов химических элементов можно последовательно отрывать все электроны, сообщив дискретные значения Еи. При этом Еи1 < Еи2 < Еи3 <….Энергии ионизации отражают дискретность структуры электронных слоев и оболочек атомов химических элементов.
4. Сродство к электрону (Ее) – количество энергии, выделяющееся при присоединении дополнительного электрона к атому, т.е. энергия процесса
Э0 + ![]() → Э—
→ Э—
Ее также выражается в эВ и, как и Еи зависит от радиуса атома, поэтому характер изменения Ее по периодам и группам Периодической системы близок характеру изменения атомного радиуса. Наибольшим сродством к электрону обладают p-элементы VII группы.
5. Восстановительная активность (ВА) – способность атома отдавать электрон другому атому. Количественная мера – Еи. Если Еи увеличивается, то ВА уменьшается и наоборот.
6. Окислительная активность (ОА) – способность атома присоединять электрон от другого атома. Количественная мера Ее. Если Ее увеличивается, то ОА также увеличивается и наоборот.
7. Эффект экранирования – уменьшение воздействия на данный электрон положительного заряда ядра из-за наличия между ним и ядром других электронов. Экранирование растет с увеличением числа электронных слоев в атоме и уменьшает притяжение внешних электронов к ядру. Экранированию противоположен эффект проникновения, обусловленный тем, что электрон может находиться в любой точке атомного пространства. Эффект проникновения увеличивает прочность связи электрона с ядром.
8. Степень окисления (окислительное число) – воображаемый заряд атома элемента в соединении, который определяется из предположения ионного строения вещества. Номер группы Периодической системы указывает высшую положительную степень окисления, которую могут иметь элементы данной группы в своих соединениях. Исключение – металлы подгруппы меди, кислород, фтор, бром, металлы семейства железа и другие элементы VIII группы. С ростом заряда ядра в периоде максимальная положительная степень окисления растет.
9. Электроотрицательность, составы высших водородных и кислородных соединений, термодинамические, электролитические свойства и т.д.
Примеры решения задач
| Задание | Охарактеризуйте элемент (Z=23) и свойства его соединений (оксидов и гидроксидов) по электронной формуле: семейство, период, группа, число валентных электронов, электронно-графическая формула для валентных электронов в основном и возбужденном состоянии, основные степени окисления (максимальная и минимальная), формулы оксидов и гидроксидов. |
| Решение |
23V 1s22s22p63s33p63d34s2
d-элемент, металл, находится в ;-м периоде, в V группе, В подгруппе. Валентные электроны 3d34s2. Оксиды VO, V2O 3, VO2, V2O5. Гидроксиды V(OH)2, V(OH)3, VO(OH)2, HVO3. 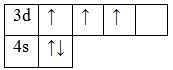
Основное состояние 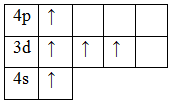
Возбужденное состояние Минимальная степень окисления «+2», максимальная – «+5». |











