Классификация веществ
Распространение химических элементов в природе
Среднее относительное содержание какого-либо химического элемента в природе называют его распространенностью (кларком) и выражают в массовых или атомных долях, а также в процентах. Химический состав и закономерности распространения и распределения элементов на Земле изучает геохимия.
Характер распространения химических элементов в земной коре сходен с характером их космической распространенности (рис. 1). В состав земной коры входит 88 химических элементов. Практически отсутствуют технеций, прометий, астат, франций и трансурановые элементы из-за их непродолжительного «времени жизни» (короткоживущие элементы). Основные элементы земной коры – кислород, кремний, алюминий, натрий, железо, кальций, магний и калий (94,5% (массовых) в сумме).
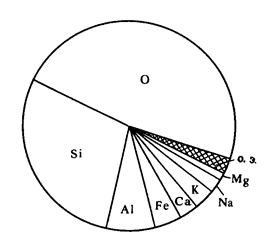
Рис. 1 Распространение химических элементов в земной коре.
Простые вещества
Один и тот же элемент способен образовывать несколько простых веществ – аллотропных модификаций. Явление аллотропии может быть обусловлено разным составом молекул данного элемента, либо способом размещения молекул или атомов в кристаллах.
Так, атомы фосфора (валентные электроны 3s23p3), имеющие три неспаренных электрона, могут объединяться в полимерные слои Р2 (рис. 2 I) с пирамидальным распределением связей или образовывать четырехатомные молекулы Р4 тетраэдрической формы (рис. 2 II)
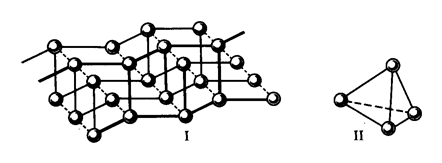
Рис. 2. Аллотропные модификации фосфора: I – Р2; II – P4.
В соответствии с характером изменения структуры и типа химической связи изменяются свойства простых веществ (плотность, температура плавления и кипения, электропроводность и т.д.). Так, аргон, хлор и сера в твердом состоянии – диэлектрики, кремний – полупроводник, а алюминий, магний и натрий – проводники.
Химические свойства, а также способы получения простых веществ (металлов и неметаллов) будут рассмотрены позднее.
Двухэлементные (бинарные) соединения
В зависимости от типа химической связи бинарные соединения – ионные, ковалентные, металлические и со смешанным типом химической связи. В соответствии с закономерным развитием электронных структур атомов характер химической связи однотипных соединений в периодах и группах Периодической системы закономерно изменяется.
Рассмотрим это явление на примере бинарных соединений элементов второго периода (рис. 3). Так, при переходе от I к VIII группе в периоде полярность химической связи уменьшается.
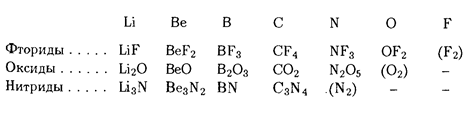
Рис. 3 Бинарные соединения элементов второго периода
Так, в ряду фторидов тип химической связи изменяется от ионного (LiF) с последующим уменьшением полярности до ковалентного неполярного (F2).
В соответствии с изменением химической природы элемента закономерно изменяются и химические свойства соединений (кислотно-основная активность). Так, в случае оксидов в ряду от Li2O до N2O5 ослабевают основные свойства и усиливаются кислотные: Li2O – сильно основный оксид, BeO – амфотерный, а B2O3, CO2 и N2O5 – кислотные.
Трехэлементные соединения
При взаимодействии резко различных по химической природе бинарных соединений образуются новые химические соединения, среди которых наиболее распространены трехэлементные соединения:
NaF + BF3 = Na[BF4]
Na2O + CO2 = Na2CO3
Трехэлементные соединения могут быть ионными, ионно-ковалентными и ковалентными в зависимости от типа химической связи между внутренней и внешней сферами.
Помимо комплексных соединений среди трехэлементных соединений различают смешанные соединения, твердые растворы и эвтектики.
Смешанные соединения получают при взаимодействии соединений элементов в равной степени склонных к образованию комплексов:
CuS + FeS = CuFeS2
MgO + Al2O3 = MgAl2O4
Твердые растворы получаются если взаимодействуют электроположительные элементы, способные образовывать близкие по строению и размеру структурные единицы:
KNO3 + RbNO3 = KNO3 — RbNO3 (твердый раствор)
MnCl2 + FeCl2 = MnCl2 — FeCl2 (твердый раствор)
Механическая смесь кристаллов (эвтектика) получается, когда между собой не взаимодействуют соединения элементов, близких по химическим свойствам, но различающихся по строению и размеру атомов или ионов:
LiCl + KCl = LiCl + KCl (эвтевтика)
Примеры решения задач
| Задание | Какую массу фосфора надо сжечь для получения оксида фосфора (V) массой 7,1 г? |
| Решение | Записываем уравнение реакции горения фосфора:
4P+ 5O2 = 2P2O5 Определяем количество вещества P2O5 ν(P2O5) = m(P2O5)/ М(P2O5) ν(P2O5) = 7,1/142 = 0,05 моль Из уравнения реакции следует ν(P2O5) = 2•ν(P) Следовательно, количество вещества фосфора равно: ν(P2O5)= 2•ν(P) = 2• 0,05= 0,1 моль Находим массу фосфора: m(Р) = ν(Р) • М(Р) m(Р) = 0,1• 31 = 3,1 г. |
| Ответ | Для получения оксида фосфора надо сжечь 3,1 г фосфора. |
| Задание | Технический карбид кальция массой 20 г обработали избытком воды, получив ацетилен, при пропускании которого через избыток бромной воды образовался 1,1,2,2 –тетрабромэтан массой 86,5 г. Определите массовую долю СаС2 в техническом карбиде. |
| Решение | Записываем уравнения взаимодействия карбида кальция с водой и ацетилена с бромной водой:
CaC2 +2H2O = Ca(OH)2 + C2H2 C2H2 +2Br2 = C2H2Br4 Находим количество вещества тетрабромэтана: ν(C2H2Br4) = m(C2H2Br4)/ М(C2H2Br4) ν(C2H2Br4) = 86,5/ 346 = 0,25 моль Из уравнений реакций следует, что ν(C2H2Br4) =ν(C2H2) = ν(СаC2) =0,25 моль Находим массу чистого карбида кальция (без примесей) m(СаC2) = ν(СаC2) • М(СаC2) m(СаC2) = 0,25• 64 = 16 г Определяем массовую долю СаC2 в техническом карбиде: ω(СаC2) =m(СаC2)/m ω(СаC2) = 16/20 = 0,8 = 80%. |
| Ответ | Массовая доля СаС2 в техническом карбиде 80%. |











