Виды гидролиза
Общие понятия
Под гидролизом понимают процесс, протекающий при взаимодействии веществ с водой. Гидролизу подвергаются соли, а также некоторые органические соединения (жиры, углеводы, белки и др.). Обязательным условием для возможности соли гидролизоваться, является наличие в её «составе» слабого иона, т.е. соль должна быть образована сильным основанием и слабой кислотой, слабым основанием и сильной кислотой или же слабым основанием и слабой кислотой.
Гидролиз по аниону
Гидролизу по аниону подвергаются соли, в образовании которых участвовали слабая кислота и сильное основание (Na2SiO3, HCOONa, CH3COOK, CaSO3 и т.д.).
Рассмотрим на примере ацетата калия (CH3COOK). Соль образована гидроксидом калия (KOH– сильное) и уксусной кислотой (CH3COOH– слабая). Одноосновная. Запишем уравнение гидролиза:
CH3COOK ↔ СH3COO— + K+ (диссоциация соли);
СH3COO— + K+ + HOH ↔ CH3COOH + K+ + OH— (ионное уравнение);
CH3COOK + H2O↔ CH3COOH + KOH (молекулярное уравнение).
Наличие гидроксид ионов свидетельствует о щелочном характере среды.
Гидролиз по катиону
Гидролизу по катиону подвергаются соли, в образовании которых участвовали сильная кислота и слабое основание (FeCl3, CuSO4, Be(NO3)2 и т.д.).
Рассмотрим на примере нитрата бериллия (Be(NO3)2). Соль образована гидроксидом бериллия (Be(OH)2 – слабое) и азотной кислоты (HNO3 – сильная). Запишем уравнение гидролиза:
а) первая ступень
Be(NO3)2 ↔ Be2+ + 2NO3— (диссоциация соли);
Be2+ + 2NO3— + HOH ↔ BeOH+ + H++ 2NO3—(ионное уравнение);
Be(NO3)2 + H2O ↔ Be(OH)NO3 + HNO3 (молекулярное уравнение).
б) вторая ступень
Be(OH)NO3 ↔ BeOH+ + NO3— (диссоциация соли);
BeOH+ + NO3— + HOH ↔ Be(OH)2 + H+ + 2NO3— (ионное уравнение);
Be(OH)NO3 + HOH ↔ Be(OH)2 + HNO3 (молекулярное уравнение).
Наличие ионов водорода свидетельствует о кислом характере среды.
Гидролиз и по катиону, и по аниону
Гидролизу и по катиону, и по аниону подвергаются соли, в образовании которых участвовали слабая кислота и слабое основание (NH4SO3, FeS, Cu(NO2)2 и т.д.).
Рассмотрим на примере сульфида серы (FeS). Соль образована гидроксидом железа (II) (Fe(OH)2 – слабое) и сероводородной кислоты (H2S – слабая). Запишем уравнение гидролиза:
FeS ↔ Fe2+ + S2- (диссоциация соли);
FeS — + HOH ↔ Fe(OH)2↓+ H2S↑ (молекулярное уравнение).
Уравнение в ионной форме в этом случае не записывают. Среда нейтральная.
Щелочной гидролиз
Гидролиз органических соединений протекает при определенных условиях. Так, в случае, если вещество гидролизуется под действием щелочей, то процесс называют щелочным гидролизом. Рассмотрим на примере галогенпроизводных:
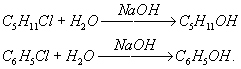
Кислотный гидролиз
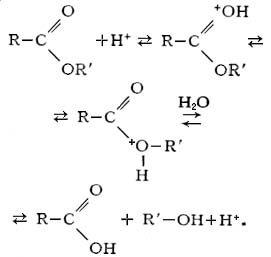
Кислотный гидролиз характерен для органических соединений. Его проводят в присутствии сильных минеральных кислот (чаще всего соляной — HCl и серной-H2SO4). Рассмотрим на примере сложных эфиров:
Ферментативный гидролиз
Условно выделяют ферментативный тип гидролиза. Это кислотный гидролиз белков и углеводов, на одной из стадий которого для более быстрого расщепления высокомолекулярных соединений в реакционную смесь вводят энзимы (ферменты).
Примеры решения задач
| Задание | Укажите тип гидролиза следующих солей: NH4Cl, NaNO2, CaSO4, ZnS, AlCl3, K2SiO3. |
| Решение | Соли хлорид аммония (NH4Cl) и хлорид алюминия (AlCl3) гидролизуются по катиону, поскольку обе образованы сильной кислотой – соляной (HCl) и слабыми основаниями – гидроксидом алюминия (Al(OH)3) и аммония (NH4OH), соответственно.
Соли нитрит натрия (NaNO2) и силикат калия (K2SiO3) гидролизуются по аниону, поскольку обе образованы сильными основаниями – гидроксидом натрия (NaOH) и калия (KOH) и слабыми кислотами – азотистой (HNO2) и кремниевой (H2SiO3), соответственно. Соль сульфид цинка (ZnS)гидролизуется и по катиону, и по аниону, поскольку в её образовании участвовали слабая кислота – сероводородная (H2S) и слабое основание – гидроксид цинка (Zn(OH)2). Соль сульфат кальция (CaSO4) гидролизу не подвергается, поскольку образована сильными кислотой (серная – H2SO4) и основанием (гидроксид кальция – Ca(OH)2). |
| Задание | Запишите уравнение кислотного гидролиза жиров в общем виде. |
| Решение | Уравнение кислотного гидролиза:
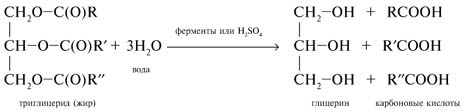
|











