Гидролиз гидрофосфата натрия
Общие сведения о гидролизе гидрофосфата натрия

Рис. 1. Гидрофосфат натрия. Внешний вид.
Брутто-формула – Na2HPO4. Молярная масса равна гидрофосфата натрия 141,96 г/моль. Молекула имеет строение:
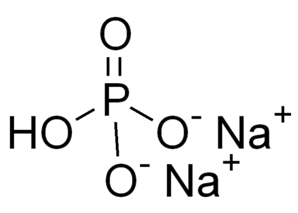
Хорошо растворяется в воде (гидролизуется по аниону). Образует изополисоединения.
Гидролиз гидрофосфата натрия
Гидрофосфат натрия представляет собой кислую соль, образованную слабой кислотой – фосфорной (H3PO4) и сильным основанием – гидроксидом натрия (NaOH):
Na2HPO4 ↔ 2Na+ +HPO42-.
Подвергается гидролизу по аниону. Характер среды водного раствора гидрофосфата натрия – щелочной. Уравнение гидролиза будет выглядеть следующим образом:
2Na+ +HPO42-+ H2O ↔ H2PO4—+ 2Na+ + OH— (полное ионное уравнение);
HPO42-+ H2O ↔ H2PO4—+ OH— (сокращенное ионное уравнение);
Na2HPO4+ H2O ↔ NaH2PO4+ NaOH (молекулярное уравнение).
Теоретически возможна вторая ступень гидролиза:
NaH2PO4↔ H2PO4—+Na+(диссоциация соли);
H2PO4—+Na++ H2O ↔ H3PO4 + Na++ OH— (полное ионное уравнение);
H2PO4—+H2O ↔ H3PO4 + OH— (сокращенное ионное уравнение);
NaH2PO4+ H2O ↔ H3PO4+ NaOH (молекулярное уравнение).
Примеры решения задач
| Задание | Составьте уравнения реакций гидролиза следующих солей в молекулярной, ионной и сокращенной ионной формах: а) NaHSO3; б) NaF; в) MgCl2; г) Na2CO3; д)FeCl3. Укажите реакцию среды. |
| Ответ | Гидролизу подвергаются соли, в составе которых присутствует «слабый ион», те. Они должны быть образованы слабой кислотой и сильным основанием, сильной кислотой и слабым основанием или слабой кислотой и слабым основанием.
а) NaHSO3↔ Na+ + HSO3—; HSO3— + HOH ↔ H2SO3 + OH—; NaHSO3 + H2O ↔ H2SO3 + NaOH. Наличие гидроксид-ионов свидетельствует о щелочном характере среды. б) NaF ↔ Na+ + F—. Слабого иона нет, поскольку соль образована сильным основанием (гидроксидом натрия) и сильной кислотой (фтороводородной). Гидролизу не подвергается. Среда нейтральная. в) MgCl2↔Mg2+ + 2Cl—. Слабого иона нет, поскольку соль образована сильным основанием (гидроксидом магния) и сильной кислотой (хлороводородной). Гидролизу не подвергается. Среда нейтральная. г) Na2CO3 ↔ 2 Na+ + CO32-; CO32- + HOH ↔ HCO3— + OH—; Na2CO3 + H2O ↔ NaHCO3 + NaOH. Наличие гидроксид-ионов свидетельствует о щелочном характере среды. д) FeCl3↔ Fe3+ + 3Cl—; Fe3+ + HOH ↔ FeOH2+ + H+; FeCl3 + H2O ↔Fe(OH)Cl2 + HCl. Наличие ионов водорода свидетельствует о кислом характере среды. |
| Задание | Установите соответствие между названием соли и отношением её к гидролизу:
|
||||||||||
| Ответ | а) Нитрат калия представляет собой соль, образованную сильной кислотой (азотной) и сильным основанием (гидроксидом калия):
KNO3↔ K+ +NO3—. Гидролизу не подвергается. Вариант 4. б) Сульфид бария представляет собой соль, образованную слабой кислотой (сероводородной) и сильным основанием (гидроксидом бария): BaS ↔ Ba2+ + S2-. Подвергается гидролизу по аниону. Вариант 2. в) хлорид алюминия представляет собой соль, образованную сильной кислотой (хлороводородной) и слабым основанием (гидроксидом алюминия): AlCl3 ↔ Al3+ + 3Cl—. Подвергается гидролизу по катиону. Вариант 1. г) карбонат натрия представляет собой соль, образованную слабой кислотой (угольной) и сильным основанием (гидроксидом натрия): Na2CO3↔2Na+ + CO32-. Подвергается гидролизу по аниону. Вариант 2. |











