Электролитическая диссоциация
Водные растворы некоторых веществ являются проводниками электрического тока. Эти вещества относятся к электролитам. Электролитами являются кислоты, основания и соли, расплавы некоторых веществ.
Растворы некоторых веществ в воде не проводят электрический ток. Такие вещества называют неэлектролитами. К ним относятся многие органические соединения, например сахар и спирты.
Теория электролитической диссоциации
Теория электролитической диссоциации была сформулирована шведским ученым С. Аррениусом (1887 г.). Основные положения теории С. Аррениуса:
— электролиты при растворении в воде распадаются (диссоциируют) на положительно и отрицательно заряженные ионы;
— под действием электрического тока положительно заряженные ионы движутся к катоду (катионы), а отрицательно заряженные – к аноду (анионы);
— диссоциация – обратимый процесс
КА ↔ К+ + А−
Механизм электролитической диссоциации заключается в ион-дипольном взаимодействии между ионами и диполями воды (рис. 1).
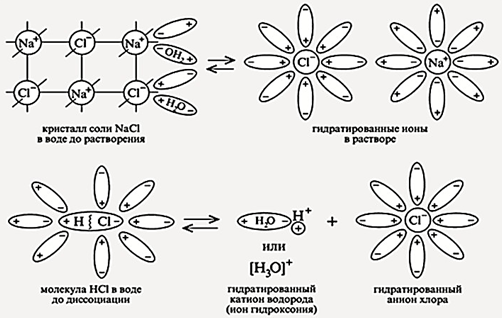
Рис. 1. Электролитическая диссоциация раствора хлорида натрия
Легче всего диссоциируют вещества с ионной связью. Аналогично диссоциация протекает у молекул, образованных по типу полярной ковалентной связи (характер взаимодействия – диполь-дипольный).
Диссоциация кислот, оснований, солей
При диссоциации кислот всегда образуются ионы водорода (H+), а точнее – гидроксония (H3O+), которые отвечают за свойства кислот (кислый вкус, действие индикаторов, взаимодействие с основаниями и т.д.).
HNO3 ↔ H+ + NO3−
При диссоциации оснований всегда образуются гидроксид-ионы водорода (OH−), ответственные за свойства оснований (изменение окраски индикаторов, взаимодействие с кислотами и т.д.).
NaOH ↔ Na+ + OH−
Соли – это электролиты, при диссоциации которых образуются катионы металлов (или катион аммония NH4+) и анионы кислотных остатков.
CaCl2 ↔ Ca2+ + 2Cl−
Многоосновные кислоты и основания диссоциируют ступенчато.
H2SO4 ↔ H+ + HSO4− (I ступень)
HSO4− ↔ H+ + SO42- (II ступень)
Ca(OH)2 ↔ [CaOH]+ + OH− (I ступень)
[CaOH]+ ↔ Ca2+ + OH−
Степень диссоциации
Среди электролитов различают слабые и сильные растворы. Чтобы охарактеризовать эту меру существует понятие и величина степени диссоциации (![]() ). Степень
диссоциации – отношение числа молекул, продиссоциировавших на ионы к общему числу молекул.
). Степень
диссоциации – отношение числа молекул, продиссоциировавших на ионы к общему числу молекул. ![]() часто выражают в %.
часто выражают в %.
![]() = N’ / N
= N’ / N
К слабым электролитам относятся вещества, у которых в децимолярном растворе (0,1 моль/л) степень диссоциации меньше 3%. К сильным электролитам относятся вещества, у которых в децимолярном растворе (0,1 моль/л) степень диссоциации больше 3%. Растворы сильных электролитов не содержат непродиссоциировавших молекул, а процесс ассоциации (объединения) приводит к образованию гидратированных ионов и ионных пар.
На степень диссоциации оказывают особое влияние природа растворителя, природа растворенного вещества, температура (у сильных электролитов с повышением температуры степень диссоциации снижается, а у слабых – проходит через максимум в области температур 60oС), концентрация растворов, введение в раствор одноименных ионов.
Амфотерные электролиты
Существуют электролиты, которые при диссоциации образуют и H+, и OH− ионы. Такие электролиты называют амфотерными, например: Be(OH)2, Zn(OH)2, Sn(OH)2, Al(OH)3, Cr(OH)3 и т.д.
H++RO− ↔ ROH ↔ R+ + OH−
Ионные уравнения реакций
Реакции в водных растворах электролитов – это реакции между ионами – ионные реакции, которые записывают с помощью ионных уравнений в молекулярной, полной ионной и сокращенной ионной формах. Например:
BaCl2 + Na2SO4 = BaSO4 ↓ + 2NaCl (молекулярная форма)
Ba2+ + 2Cl− + 2Na+ + SO42- = BaSO4 ↓ + 2Na+ + 2Cl− (полная ионная форма)
Ba2+ + SO42- = BaSO4 ↓ (сокращенная ионная форма)
Водородный показатель pH
Вода – слабый электролит, поэтому процесс диссоциации протекает в незначительной степени.
H2O ↔ H+ + OH−
К любому равновесию можно применить закон действующих масс и записать выражение для константы равновесия:
K = [H+][OH−]/[H2O]
Равновесная концентрация воды – величина постоянная, слеовательно.
K[H2O] = [H+][OH−] = KW
Кислотность (основность) водного раствора удобно выражать через десятичный логарифм молярной концентрации ионов водорода, взятый с обратным знаком. Эта величина называется водородным показателем (рН):
рН = — lg[H+]
Если раствор нейтральный, то [H+]=[OH−] =10-7, рН =7.
Если среда кислая [H+] > 10-7, рН < 7.
Если среда щелочная [H+] < 10-7, рН > 7
Примеры решения задач
| Задание | Напишите схемы диссоциации электролитов HNO3, H2S, LiOH, H3AsO4, Cu(OH)NO3. |
| Решение |
HNO3 ↔ H+ + NO3−
H2S↔ 2H+ + S2- LiOH↔Li+ + OH− H3AsO4 ↔ AsO4− + 3H+ Cu(OH)NO3 ↔ Cu(OH)+ + NO3− Cu(OH)+ ↔ Cu2+ + OH− |
| Задание | Изобразите схемы диссоциации амфотерных электролитов Al(OH)3, Be(OH)2. |
| Решение |
Al(OH)3 ↔ Al3+ + 3OH− (основный механизм)
Al(OH)3 + 3H2O ↔ 3H+ + [Al(OH)6]3- (кислотный механизм) Be(OH)2 ↔ Be2+ + 2OH− (основный механизм) Be(OH)2 + 2H2O ↔ 2H+ + [Be(OH)4]2- (кислотный механизм) |











