Амфотерные органические и неорганические соединения
К амфотерным неорганическим соединениям относят оксиды и гидроксиды следующих металлов – Al, Zn, Be, Cr (в степени окисления +3) и Ti (в степени окисления +4). Амфотерными органическими соединениями являются аминокислоты – NH2–CH(R)-COOH.
Получение амфотерных соединений
Амфотерные оксиды получают путем реакции горения соответствующего металла в кислороде, например:
2Al + 3/2O2 = Al2O3
Амфотерные гидроксиды получают по реакции обмена между щелочью и солью, содержащий «амфотерный» металл:
ZnSO4 + NaOH = Zn(OH)2 + Na2SO4
Если щелочь присутствует в избытке, то есть вероятность получения комплексного соединения:
ZnSO4 + 4NaOHизб = Na2[Zn(OH)4] + Na2SO4
Органические амфотерные соединения – аминокислоты получают путем замещения галогена на аминогруппу в галогензамещенных карбоновых кислотах. В общем виде уравнение реакции будет выглядеть так:
R-CH(Cl)-COOH + NH3 = R-CH(NH3+Cl—) = NH2–CH(R)-COOH
Химические амфотерных соединений
Главным химическим свойством амфотерных соединений является их способность реагировать с кислотами и щелочами:
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Al2O3 + NaOH+ 3H2O= 2Na[Al(OH)4]
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H2O
Zn(OH)2 + NaOH= Na2[Zn(OH)4]
NH2–CH2-COOH + HCl = Cl[NH3–CH2-COOH]
NH2–CH2-COOH + NaOH= NH2–CH2-COONa + H2O
Специфические свойства амфотерных органических соединений
При растворении аминокислот в воде аминогруппа и карбоксильная группа взаимодействуют друг с другом с образованием соединений, называемых внутренними солями:
NH2–CH2-COOH ↔ +H3N–CH2-COO—
Молекулу внутренней соли называют биполярным ионом.
Две молекулы аминокислоты могут взаимодействовать друг с другом. При этом происходит отщепление молекулы воды и образуется продукт, в котором фрагменты молекулы связаны между собой пептидной связью (-CO-NH-). Например:
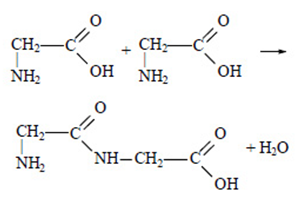
Также для аминокислот характерны все химические свойства карбоновых кислот (по карбоксильной группе) и аминов (по аминогруппе).
Примеры решения задач
| Задание | Осуществите ряд превращений: а) Al → Al(OH)3 → AlCl3 → Na[Al(OH)4]; б) Al → Al2O3 → Na[Al(OH)4] → Al(OH)3 → Al2O3 → Al |
| Решение | a) 2Al +6H2O = 2Al(OH)3 + 3H2↑
Al(OH)3 + 3HCl = AlCl3 + 3H2O AlCl3 + 4NaOHизб = Na[Al(OH)4] + 3NaCl б) 2Al + 3/2O2 = Al2O3 Al2O3 + NaOH+ 3H2O= 2Na[Al(OH)4] 2Na[Al(OH)4] + H2SO4 = 2Al(OH)3 + Na2SO4 + 2H2O 2Al(OH)3 = Al2O3 + 3H2O 2Al2O3 = 4Al +3O2 |
| Задание | Вычислите массу соли, которую можно получить при взаимодействии 150 г 5%-го раствора аминоуксусной кислоты с необходимым количеством гидроксида натрия. Сколько граммов 12%-го раствора щелочи для этого потребуется? |
| Решение | Запишем уравнение реакции:
NH2–CH2-COOH + NaOH= NH2–CH2-COONa + H2O Вычислим массу кислоты, вступившей в реакцию: m(NH2–CH2-COOH) = ώк—ты×mр—ра m(NH2–CH2-COOH)= 0,05 × 150 = 7,5 г Найдем количество вещества этой кислоты: v(NH2–CH2-COOH)= mк-ты / Мк-ты v(NH2–CH2-COOH)=7,5/75 = 0,1 моль По уравнению: v(NH2–CH2-COOH)= v(NaOH)= v(NH2–CH2-COONa) = 0,1 моль Найдем массу соли, которая образовалась в ходе реакции: m(NH2–CH2-COONa) = 0,1 × 97 = 9,7 г Найдем массу гидроксида натрия: m(NaOH)= 0,1 × 40 = 4 г Найдем массу раствора гидроксида натрия: msolution(NaOH) = 4/0,12 = 33,3 г |
| Ответ | Масса соли 9,7 г и масса раствора щелочи 33,3 г. |











