Уравнение Майера
Именно в этом простом уравнении заключена физическая суть величины ![]() – универсальной газовой постоянной, равной 8,31 Дж/(моль • К).
– универсальной газовой постоянной, равной 8,31 Дж/(моль • К).
Запись уравнения Майера
Уравнение Майера записывают в виде:
![]()
В нём сp – молярная теплоёмкость при постоянном давлении, а сv соответственно – в условиях постоянного объема.
Молярная теплоемкость указывает, сколько теплоты в Джоулях следует подводить к одному молю газа, чтобы нагреть его на 1 Кельвин. Молярную теплоемкость изохорного процесса можно определить по следующей формуле:
![]()
где i – количество степеней свободы для молекулы газа. С учётом уравнения Майера, получим формулу для расчёта изобарной молярной теплоемкости:
![]()
Расчеты с использованием уравнения Майера
В практических расчётах часто используют удельную массовую теплоемкость, и как раз она обычно приводится в таблицах теплофизических величин. Умножив молярную теплоёмкость газа на его молярную массу, мы получим удельную массовую теплоемкость:
![]()
![]()
Зачем вообще понадобилось разграничивать изохорную и изобарную теплоемкости?
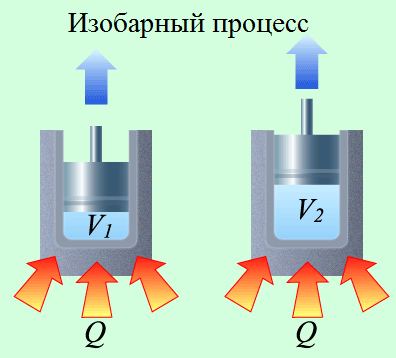
При изобарном процессе (процессе с постоянным давлением) первый закон термодинамики представляется формулой:
![]()
где ![]() — количество теплоты, подведенное к газу,
— количество теплоты, подведенное к газу, ![]() – изменение внутренней энергии газа,
– изменение внутренней энергии газа, ![]() – работа расширения, которую совершил газ.
– работа расширения, которую совершил газ.
А это значит, что теплота, подведённая к газу в изобарном процессе, будет потрачена на изменение его внутренней энергии и работу по его расширению.
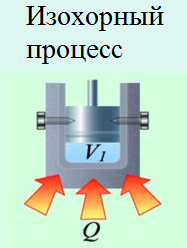
Если же газ закрыть в замкнутом объёме (изохорный процесс), то работа по его расширению выполняться не будет (![]() ), и вся подводимая теплота будет потрачена на изменение внутренней энергии:
), и вся подводимая теплота будет потрачена на изменение внутренней энергии:
![]()
Если от первого выражения отнять второе, получим:
![]()
![]()
![]()
Таким образом, газовая постоянная R определяет работу, затраченную на расширение одного моля газа при нагреве его на 1 Кельвин при постоянном давлении.
В основном уравнение Майера используется в теории тепловых машин и теплогидравлике для определения теплофизических характеристик рабочих тел. Однако оно нашло применение и в квантовой физике: постоянная Планка, связывающая энергию кванта света с его частотой, была получена с учётом физического смысла универсальной газовой постоянной.
Примеры решения задач
| Задание | Молярная изохорная теплоемкость углекислого газа 28,825 Дж/(моль•К). Найти теплоемкость 1 л углекислого газа при постоянном давлении. |
| Решение | Найдём изобарную молярную теплоёмкость по формуле Майера:
Зная теплоемкость 1 моля углекислого газа, находим изобарную теплоёмкость 1 л углекислого газа:
|
| Ответ | 831,8 Дж/К. Значит, чтобы нагреть 1 литр углекислого газа на 1 Кельвин, нужно затратить 831,8 Дж |
| Задание | Газовая смесь состоит из 5 кг диоксида углерода СО2 и 8 кг диазота N2. Изобарные молярные теплоемкости указанных газов при температуре Т=298,15 К равны 
|
| Решение | 1) Определим молярные массы каждого из компонентов смеси:
2) Определим количество вещества каждого из компонентов смеси (в молях):
3) Вычислим общую изобарную теплоемкость смеси:
4) По уравнению Майера определим общую изохорную теплоемкость смеси. Обратите внимание, что теплоемкость в формуле (3) вычислена не для одного моля газовой смеси, а для всего её количества. Фактически, удельная молярная изобарная теплоемкость была умножена на общее количество молей газовой смеси. Поэтому и постоянную R в формуле Майера следует умножить на общее количество молей газовой смеси.
5) Определим удельную изохорную теплоемкость смеси на единицу массы:
|
| Ответ |











