Уравнение Гиббса
Определение и формула уравнения Гиббса
Однако это уравнение имеет и более интересное, специфичное применение: оно позволяет определить, возможно ли вообще (а если возможно – при каких условиях?) осуществить тот или иной термодинамический процесс. Чаще всего его используют в химии, чтобы узнать, будет ли протекать химическая реакция, а может, реагенты для этого нужно охладить или нагреть? Уравнение Гиббса применяется для изобарно-изотермических процессов, а именно такими и являются химические реакции и фазовые переходы.
Уравнение имеет вид:
![]()
![]() — изменение энтальпии системы, Т – её абсолютная температура, S – энтропия.
— изменение энтальпии системы, Т – её абсолютная температура, S – энтропия. ![]() – свободная энергия Гиббса, которую еще называют «изобарно-изотермический потенциал».
– свободная энергия Гиббса, которую еще называют «изобарно-изотермический потенциал».
Проанализировать уравнение будет удобнее, записав его в несколько другом виде:
![]()
Энтальпия ![]() – сумма внутренней энергии системы и работу, которую может выполнить система при давлении p. Грубо говоря, энтальпия – это полное содержание энергии в системе. Энтропийный фактор
– сумма внутренней энергии системы и работу, которую может выполнить система при давлении p. Грубо говоря, энтальпия – это полное содержание энергии в системе. Энтропийный фактор ![]() – та часть энергии системы, которая не может быть потрачена на полезную работу, а может только рассеяться в окружающую среду в виде тепла, увеличивая хаотичность системы. Энергия Гиббса
– та часть энергии системы, которая не может быть потрачена на полезную работу, а может только рассеяться в окружающую среду в виде тепла, увеличивая хаотичность системы. Энергия Гиббса ![]() — максимальная полезная работа, которую может выполнить система.
— максимальная полезная работа, которую может выполнить система.
Термодинамический процесс осуществим, если ![]() — в этом процессе система будет переходить в состояние равновесия
— в этом процессе система будет переходить в состояние равновесия ![]() . При
. При ![]() процесс не разрешен – если в конечном состоянии энергия, которая могла бы уйти на полезную работу, возросла в сравнении с начальным состоянием, значит, она вообще не тратилась при осуществлении процесса. Значит, и процесс-то этот невозможен.
процесс не разрешен – если в конечном состоянии энергия, которая могла бы уйти на полезную работу, возросла в сравнении с начальным состоянием, значит, она вообще не тратилась при осуществлении процесса. Значит, и процесс-то этот невозможен.
Величина свободной энергии Гиббса
Величину свободной энергии Гиббса может определять как фактор энтальпии, так и энтропии. Рассмотрим это на примерах химических реакций:
1) ![]() ,
, ![]() – в этом случае
– в этом случае ![]() — реакцию можно провести при любой температуре. Такой расклад характерен, например, для горения углеводородов.
— реакцию можно провести при любой температуре. Такой расклад характерен, например, для горения углеводородов.
2) ![]() ,
, ![]() – изменение энергии Гиббса больше нуля. Реакция однозначно не осуществима.
– изменение энергии Гиббса больше нуля. Реакция однозначно не осуществима.
3) ![]() ,
, ![]() – реакция возможна при низкой температуре. Если температура в
– реакция возможна при низкой температуре. Если температура в ![]() будет небольшой, энтропийная составляющая будет возрастать медленно, и энергия Гиббса будет уменьшатся. Именно так проходит процесс синтеза аммиака без катализатора:
будет небольшой, энтропийная составляющая будет возрастать медленно, и энергия Гиббса будет уменьшатся. Именно так проходит процесс синтеза аммиака без катализатора: ![]() . Правда, скорость реакции при этом мала, и в промышленности применяют метод Габера – с катализатором и при высоких температурах.
. Правда, скорость реакции при этом мала, и в промышленности применяют метод Габера – с катализатором и при высоких температурах.
4) ![]() – реакция возможна при высокой температуре. Тогда отрицательный энтропийный фактор уравновесит положительное изменение энтальпии, и энергия Гиббса уменьшается. Если нагреть тетраоксид азота (окислитель ракетного топлива), он разложится на окись азота, важный трансмиттер газов в живых организмах:
– реакция возможна при высокой температуре. Тогда отрицательный энтропийный фактор уравновесит положительное изменение энтальпии, и энергия Гиббса уменьшается. Если нагреть тетраоксид азота (окислитель ракетного топлива), он разложится на окись азота, важный трансмиттер газов в живых организмах: ![]() .
.
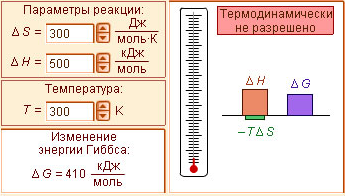
Изменение энергии Гиббса указывает на термодинамическую возможность реакции – но это не значит, что реакция обязательно будет (не)осуществима в реальных условиях. На практике на возможность протекания реакции влияют и кинетические факторы: концентрация реагентов, контактная поверхность между фазами, наличие катализаторов.
Примеры решения задач
| Задание | Реакция |
| Решение | Оценим, как изменяется энтропия реагентов (для удобства примем количество вещества кислорода 1 моль). На входе мы имеем объем реагентов:
В то же время объем образовавшейся воды (в качестве единицы массы используем граммы, единицы объема – литры):
Так как объем вещества при изобарно-изотермическом процессе значительно уменьшается, то уменьшается и энтропия. Исходя из уравнения Гиббса: — если изменение и энергии Гиббса, и энтальпии отрицательны, то протекание реакции определяет изменение энтальпии. |
| Ответ | Энтальпийный фактор |
| Задание | Может ли при 298,15 К самопроизвольно протекать реакция |
| Решение | За таблицами найдем значение энергий Гиббса и энтропий для исходных продуктов и продуктов реакции:

Так как Найдем изменение энтропии:
Исходя из уравнения Гиббса 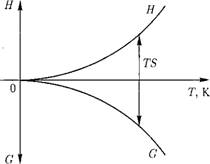
|
| Ответ | Нет; реакция сможет протекать при температурах |











