Термохимические уравнения
В ходе химической реакции изменяется энергетическое состояние системы. Важнейшими функциями состояний являются характеристические функции такие как:
- внутренняя энергия U,
- энтальпия (теплосодержание) H,
- энтропия S,
- изохорно-изотермический потенциал (свободная энергия) F,
- изобарно-изотермический потенциал (потенциал Гиббса) Ф.
Вышеперечисленные функции зависят от массы и называются экстенсивными. Кроме того, особенностями этих функций относят то, что они зависят от количества вещества и не зависят от способа достижения состояния.
В связи с термохимическими уравнениями нас более всего интересует энтальпия химической реакции ![]() , которая есть тепловой эффект реакции. Реакция называется экзотермической, если в результате ее протекания теплота выделяется:
, которая есть тепловой эффект реакции. Реакция называется экзотермической, если в результате ее протекания теплота выделяется: ![]() и эндотермической, если теплота поглощается
и эндотермической, если теплота поглощается ![]() .
.
Использование термохимических уравнений
Термохимические уравнения используются для расчета тепловых эффектов. Такие уравнения включают в себя химическую формулу реакции, тепловой эффект реакции, кроме того указывается агрегатное состояние вещества (веществ). Числовое значение в уравнении реакции строго соответствует количествам веществ, участников реакции, то есть коэффициентам. Благодаря этому соответствию, можно установить пропорциональные отношения между количеством вещества или массой и количеством теплоты в этой реакции.
Стандартная теплота образования вещества равна тепловому эффекту реакции образования 1 моль данного вещества из простых веществ в стандартных состояниях ( при давлении 1 атмосфера и заданной температуре).
Основы термохимических уравнений, закон Гесса
В основе термодинамических расчетов лежит закон Гесса: Тепловой эффект реакции, протекающей в системе при постоянном объеме или постоянном давлении, не зависит от промежуточных состояний, а определяется лишь начальным и конечным состоянием системы. В изохорном процессе ![]() , в изобарном процессе
, в изобарном процессе ![]() , где
, где ![]() — тепловые эффекты соответствующих процессов.
— тепловые эффекты соответствующих процессов.
Закон Гесса, выражает первый закон термодинамики применительно к химическим реакциям (это основной закон термохимии). Из него вытекают следствия, которые упрощают расчет химических реакций, протекающих в системе при p=const или V=const:
- тепловой эффект реакции разложения химического соединения численно равен и противоположен по знаку тепловому эффекту реакции синтеза этого соединения из продуктов разложения;
- разность тепловых эффектов двух реакций, приводящих из разных состояний к одинаковым конечным состояниям, равна тепловому эффекту реакции перехода из одного начального состояния в другое;
- разность тепловых эффектов двух реакций, приводящих из одного исходного состояния к разным конечным состояниям, равна тепловому эффекту реакции перехода из одного конечного состояния в другое.
Закон Гесса позволяет оперировать термохимическими уравнениями, как алгебраическими.
Пример термохимического уравнения: ![]() кДж — термохимическое уравнение . Реакция эндотермическая.
кДж — термохимическое уравнение . Реакция эндотермическая.
Зависимость количества теплоты, выделяющейся в реакции (E) от теплового эффекта реакции (Eo) и количества вещества (nb) одного из участников реакции (вещества b – исходного вещества или продукта реакции) выражается уравнением:
![]()
Здесь ![]() – количество вещества b, задаваемое коэффициентом перед формулой вещества b в термохимическом уравнении.
– количество вещества b, задаваемое коэффициентом перед формулой вещества b в термохимическом уравнении.
Примеры решения задач
| Задание | При окислении 108 г алюминия кислородом выделяется 3351 кДж теплоты, а при взаимодействии 64 г 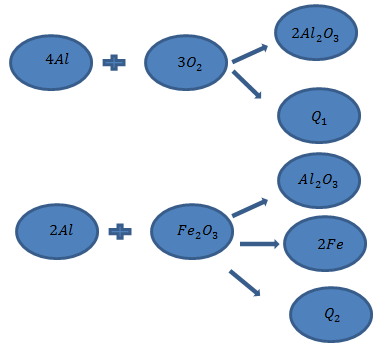
рис. 1 |
| Решение | Основой для решения задачи являются термохимические уравнения и закон Гесса, который позволяет работать с термохимическими уравнениями как алгебраическими.
Запишем термохимическое уравнение окисления алюминия: Определим, какое количество молей алюминия дано в задаче, зная (из таблицы Менделеева)
В таком случае Запишем второе термохимическое уравнение:
Так как в реакции участвует 1 моль оксида железа, то:
Теплоту образования железа (III) можно рассчитать из термохимического уравнения: Для того, чтобы получить уравнение (1.5) надо уравнение (1.1) умножить на коэффициент 0,5; уравнение (1.3) умножить на (-1) и полученные уравнения сложить, получим: сложим (1.6) и (1.7), получим: Соответственно: Проведем расчёт: |
| Ответ | Теплота образования оксида железа (III) в данной задаче 821,3 кДж/моль. |
| Задание |
Вычислите по термохимическому уравнению |
| Решение |
Найдем количество молей Так как в приведенной реакции участвуют 4 моль фосфора, то при заданных условиях находим количество выделяемой теплоты как: |
| Ответ | Количество теплоты, выделяемое при сгорании 30,9 гр фосфора 752,5 кДж. |











