Физические и химические свойства серы
Электронная конфигурация 1s22s22p63s23p4. Символ – S . Относительная атомная масса – 32 а.е.м. Температура кипения – 444,67![]() С, плавления – 112,85
С, плавления – 112,85![]() С. Неметалл.
С. Неметалл.
Химические свойства серы
Сера взаимодействует с простыми веществами – неметаллами, проявляя при этом свойства восстановителя. Непосредственно сера взаимодействует только с фтором. Реакции взаимодействия с другими металлами происходят при нагревании:
S + F2 = SF6;
2S + Cl2 = S2Cl2;
S + Cl2 = SCl2;
5S + 2P = P2S5;
S + H2 = H2S;
2S + C = CS2;
S + O2 = SO2;
2S + Br2 = S2Br2.
В реакциях взаимодействия с простыми веществами – металлами сера проявляет свойства окислителя. Эти реакции протекают при нагревании и очень бурно:
2Na + S = Na2S;
Ca + S = CaS
2Al + 3S = Al2S3;
Fe + S = FeS.
Сера вступает в реакции взаимодействия со сложными веществами. Она способна растворяться в концентрированных кислотах и расплавах щелочей, причем в последнем случае сера диспропорционирует. Эти реакции происходят при кипении реакционной смеси:
3S + 6KOH = K2SO3 +2K2S + 3H2O;
S + 6HNO3 = H2SO4 + 6NO2↑ + 2H2O;
S + 2H2SO4 = 3SO2↑ + 2H2O.
При взаимодействии серы с сульфидами металлов происходит образование полисульфидов:
Na2S + S = Na2S2.
Физические свойства серы
Сера – кристаллическое вещество желтого цвета. Существует в виде двух аллотропных модификаций – α-серы (ромбическая кристаллическая решетка) и β-серы (моноклинная кристаллическая решетка), а также аморфной формы – пластическая сера (рис. 1). В кристаллическом состоянии сера построена из неплоских циклических молекул S8. Сера плохо растворяется в этаноле, хорошо в сероуглероде и жидком аммиаке. Не реагирует с жидкой водой и йодом.
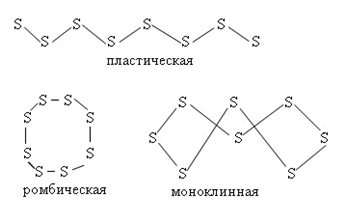
Рис. 1. Формы существования серы.
Получение и применение серы
В промышленных масштабах серу получают из природных месторождений самородной серы. Сера является сырьем для производства серной кислоты. Е1 используют в бумажной промышленности, в сельском хозяйстве, в производстве резины, красителей, пороха и т.д. Широкое применение сера нашла в медицине, например, сера входит в состав различных мазей и присыпок, применяемых при кожных заболеваниях и т.д.
Примеры решения задач
| Задание | Какое количество вещества атомарной серы содержится в сульфиде железа (II) массой 22 г. |
| Решение |
Молярная масса сульфида железа (II), рассчитанная с использованием таблицы химических элементов Д.И. Менделеева – 88 г/моль. Тогда, количество вещества сульфида железа (II) будет равно:
n(FeS) = m(FeS) / M(FeS); n(FeS) = 22 / 88 = 0,25 моль. Т.к. в состав молекулы сульфида железа (II) входит один атом серы, то количество вещества атомарной серы будет также равно 0,25 моль. |
| Ответ | Количество вещества атомарной серы — 0,25 моль. |
| Задание | При взаимодействии серы с концентрированной азотной кислотой (ω = 60%, ρ = 1,27 г/мл) образовалась серная кислота и выделился оксид азота (II), объемом 67,2 л. Какая масса серы и какой объем раствора азотной кислоты потребовались для этого? |
| Решение |
Запишем уравнение реакции:
S + 2HNO3 = 2NO + H2SO4. Рассчитаем количество вещества оксида азота (II): n(NO) = V(NO) / Vm ; n(NO) = 67,2 / 22,4 = 3 моль. Согласно уравнению n(NO):n(S) = 2:1, следовательно n(S) = 1/2×n(NO) = 1,5 моль. Молярная масса серы, рассчитанная с использованием таблицы химических элементов Д.И. Менделеева – 32 г/моль. Тогда масса серы, вступившей в реакцию будет равна: m(S) = n(S) × M(S) = 1,5 × 32 = 48 г. Согласно уравнению n(NO):n(HNO3) = 2:2, следовательно n(HNO3) = n(NO) = 3 моль. Молярная масса азотной кислоты, рассчитанная с использованием таблицы химических элементов Д.И. Менделеева – 63 г/моль. Тогда масса азотной кислоты, вступившей в реакцию будет равна: m(HNO3) = n(HNO3) × M(HNO3) = 3 × 63 = 189 г. Масса раствора азотной кислоты: m(HNO3)solution = m(HNO3) / ω = 189 / 0,6 = 315 г. Тогда объем раствора азотной кислоты, вступившей в реакцию: V(HNO3) = m(HNO3)solution / ρ = 315 / 1,27 = 229,9 мл. |
| Ответ | Масса серы – 48 г; объем раствора азотной кислоты — 229,9 мл. |











