Физические и химические свойства циклоалканов
Общая формула циклоалканов – CnH2n
Атомы углерода в молекулах циклоалканов связаны между собой только σ – связями. Циклоалканы широко распространены в природе. Они входят в состав нефти, смоляных кислот, стероидных гормонов, простограндинов, терпенов, витаминов и т.д.
Существует несколько классификаций циклоалканов: по числу атомов углерода в цикле, по количеству циклов в молекуле, по способу соединения циклических составляющих и т.д.
Устойчивость циклоалканов связана с степенью напряжения энергетического состояния молекулы. Устойчивость циклоалканов тем ниже, чем меньше атомов углерода входит в состав цикла.
Для циклоалканов характерна изомерия углеродного скетлета, стерео- или цис-транс-изомерия, пространственная изомерия а также межклассовая изомерия с алкенами.
Химические свойства циклоалканов
Для малых циклоалканов (С3-С4) характерны реакции присоединения, протекающие по радикальному механизму, в результате чего может происходить даже разрыв цикла. К таким реакциям относят галогенирование, которое проводят под действием УФ-излучения и при нагревании. Температура нагрева влияет на характер продуктов реакции присоединения хлора, присоединение брома, вне зависимости от внешних факторов протекает с разрывом цикла:
C3H6 + Cl2 → C2H5-Cl + HCl (t < 100![]() C);
C);
C3H6 + Cl2 → Cl-CH2-CH2-CH2-Cl + H2↑ (t > 100![]() C).
C).
Для малых циклов характерны реакции гидрирования, в результате которых образуются алканы. Условием протекания реакции служит нагрев и присутствие катализатора – никеля или платины:
C4H8 + H2 → CH3-(CH2)2-CH3.
Для циклоалканов среднего размера (С5-С6) характерны реакции замещения, протекающие по радикальному механизму, например, галогенирование. В этом случае получают моногалогенпроизводные циклоалканов. Однако, можно получить и полигалогенпроизводные циклоалканов:
C5H10 + Br2 → C5H9-Br + HBr;
C6H12 + Br2 → C6H11-Br + HBr;
C6H12 + 6Cl2 → C6H6Cl6 + 6HCl.
Окисление циклоалканов приводит к образованию двухосновных карбоновых кислот, циклических спиртов или циклических кетонов:
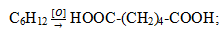
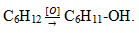
Для циклоалканов характерны реакции изомеризации:
С3Н5-СН3 ↔ С4Н8;
С3Н5-СН2 – OH ↔ C4H6 + H2O (kat = H2SO4).
Реакция дегидрирования циклогексана и его производных – один из способов получения бензола и его гомологов (реакция протекает при нагревании и в присутствии катализатора – платины):
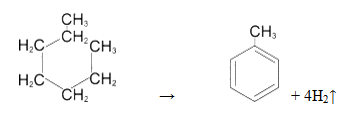
Физические свойства циклоалканов
Низшие циклоалканы (С3-С4) – газообразные вещества, средние (С5-С11) – жидкости, а высшие (> C12) – твердые вещества. Циклоалканы практически нерастворимы в воде. С ростом молекулярной массы, температура плавления циклоалканов увеличивается.
Получение циклоалканов
Низшие циклоалканы получают путем их синтеза из дигалогенпроизводных алканов:
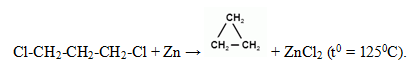
Средние циклоалканы получают следующим способом:
Br-(CH2)4-Br + 2LiHg = C4H8 + 2LiBr + Hg;
Br-(CH2)5-Br + 2LiHg = C5H10 + 2LiBr + Hg;
Циклоалканы с 5-ю и более атомами углерода можно получить пиролизом кальциевых или натриевых солей двухосновных карбоновых кислот (метод Ружичка). Циклогексан и его производные получают из нефти или по реакции гидрирования бензола и его гомологов.
Примеры решения задач
| Задание | Относительная плотность паров циклоалкана по азоту равна 5. Определите формулу циклоалкана и назовите его. |
| Решение |
Пусть формула циклоалкана СхНу. Рассчитаем молекулярную массу циклоалкана с использованием значения его относительной плотности паров по азоту:
M(CxHy) = D(N2) ×M(N2) = 5×28 = 140. Формула циклоалканов в общем виде – CnH2n, выведем формулу для вычисления молекулярной массы циклоалкана с использованием общей формулы: M(CnH2n) = 12n + 2n = 14n. Приравняем полученные значения молекулярных масс: 14n = 140; n = 10. Следовательно, формула циклоалкана – С10Н20, это циклодекан. |
| Ответ | Формула циклоалкана – С10Н20, это циклодекан. |
| Задание | 1,875 г органического соединения при н.у. занимает объем, равный 1л. При сжигании 4,2 г этого вещества образуется 13,2 г углекислого газа и 5,4 г воды. Определите формулу органического соединения. |
| Решение |
Количества вещества газообразного соединения можно определить с использованием следующих формул:
n = m/M; n = V/Vm. Приравняем правые части записанных выше формул и выразим молярную массу: M = m×Vm/V. Тогда молярная масса органического соединения будет равна: M = 1,875×22,4/1 = 42 г/моль. При сжигании органических веществ углерод преобразуется в углекислый газ, а водород – в воду. Составим пропорции: C→CO2 (1); 2H→H2O (2). Согласно 1 уравнению n(C):n(CO2) = 1:1, следовательно n(C) = n(CO2) = 5,4/18×2 = 0,3 моль. Масса углерода будет равна 3,6 г. Согласно 2 уравнению n(H):n(H2O) = 2:1, следовательно n(H) = 2×n(H2O) = 13,2/44 = 0,6 моль. Масса углерода будет равна 0,6 г. Проверим наличие кислорода в составе органического соединения: m(O2) = m – m(C) – m(H) = 4,2 – 3,6 – 0,6 = 0г. Следовательно, в составе органического соединения нет кислорода. Составим пропорцию: n(C):n(H) = 0,3:0,6 = 1:2. Следовательно, формула СН2. Молярная масса – 14 г/моль, однако, известно (см. вычисления выше), что истинная молярная масса вещества 42г/моль. Тогда: M(CxHy)/M(CH2) = 42/14 = 3. Истинная формула углеводорода – С3Н6. |
| Ответ | Формула углеводорода – С3Н6 |











