Физические и химические свойства аммиака
Формула – NH3. Молярная масса – 17 г/моль.
Физические свойства аммиака
Аммиак (NH3) – бесцветный газ с резким запахом (запах «нашатырного спирта»), легче воздуха, хорошо растворим в воде (один объем воды растворят до 700 объемов аммиака). Концентрированный раствор аммиака содержит 25% (массовых) аммиака и имеет плотность 0,91 г/см3.
Связи между атомами в молекуле аммиака – ковалентные. Общий вид молекулы AB3. В гибридизацию вступают все валентные орбитали атома азота, следовательно, тип гибридизации молекулы аммиака – sp3. Аммиак имеет геометрическую структуру типа AB3E – тригональная пирамида (рис. 1).
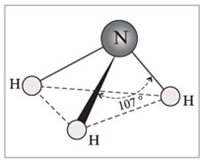
Рис. 1. Строение молекулы аммиака.
Химические свойства аммиака
В химическом отношении аммиак довольно активен: он вступает в реакции взаимодействия со многими веществами. Степень окисления азота в аммиаке «-3» — минимальная, поэтому аммиак проявляет только восстановительные свойства.
При нагревании аммиака с галогенами, оксидами тяжелых металлов и кислородом образуется азот:
2NH3 + 3Br2 = N2 + 6HBr
2NH3 + 3CuO = 3Cu + N2 + 3H2O
4NH3 +3O2 = 2N2 + 6H2O
В присутствии катализатора аммиак способен окисляться до оксида азота (II):
4NH3 + 5O2 = 4NO + 6H2O (катализатор – платина)
В отличие от водородных соединений неметаллов VI и VII групп, аммиак не проявляет кислотные свойства. Однако, атомы водорода в его молекуле все же способны замещаться на атомы металлов. При полном замещении водорода металлом происходит образование соединений, называемых нитридами, которые также можно получить и при непосредственном взаимодействии азота с металлом при высокой температуре.
Основные свойства аммиака обусловлены наличием неподеленной пары электронов у атома азота. Раствор аммиака в воде имеет щелочную среду:
NH3 + H2O ↔ NH4OH ↔ NH4+ + OH—
При взаимодействии аммиака с кислотами образуются соли аммония, которые при нагревании разлагаются:
NH3 + HCl = NH4Cl
NH4Cl = NH3 + HCl (при нагревании)
Получение аммиака
Выделяют промышленные и лабораторные способы получения аммиака. В лаборатории аммиак получают действием щелочей на растворы солей аммония при нагревании:
NH4Cl + KOH = NH3↑ + KCl + H2O
NH4+ + OH— = NH3↑+ H2O
Эта реакция является качественной на ионы аммония.
Применение аммиака
Производство аммиака – один из важнейших технологических процессов во всем мире. Ежегодно в мире производят около 100 млн. т. аммиака. Выпуск аммиака осуществляют в жидком виде или в виде 25%-го водного раствора – аммиачной воды. Основные направления использования аммиака – производство азотной кислоты (производство азотсодержащих минеральных удобрений в последствии), солей аммония, мочевины, уротропина, синтетических волокон (нейлона и капрона). Аммиак применяют в качестве хладагента в промышленных холодильных установках, в качестве отбеливателя при очистке и крашении хлопка, шерсти и шелка.
Примеры решения задач
| Задание | Каковы масса и объем аммиака, которые потребуются для получения 5т нитрата аммония? |
| Решение |
Запишем уравнение реакции получения нитрата аммония из аммиака и азотной кислоты:
NH3 + HNO3 = NH4NO3 По уравнению реакции количество вещества нитрата аммония равно 1 моль — v(NH4NO3) = 1моль. Тогда, масса нитрата аммония, рассчитанная по уравнению реакции: m(NH4NO3) = v(NH4NO3)×M(NH4NO3); m(NH4NO3) = 1×80 = 80 т Согласно уравнению реакции, количество вещества аммиака также равно 1 моль — v(NH3) = 1моль. Тогда, масса аммиака, рассчитанная по уравнению: m(NH3) = v(NH3)×M(NH3); m(NH3) = 1×17 = 17 т Составим пропорцию и найдем массу аммиака (практическую): х г NH3 – 5 т NH4NO3 17 т NH3 – 80 т NH4NO3 х = 17×5/80 = 1,06 m(NH3) = 1,06 т Аналогичную пропорцию составим для нахождения объема аммиака: 1,06 г NH3 – х л NH3 17 т NH3 – 22,4×103 м3 NH3 х = 22,4×103×1,06 /17 = 1,4×103 V(NH3) = 1,4×103 м3 |
| Ответ | Масса аммиака — 1,06 т, объем аммиака — 1,4×10 |
| Задание |
Промышленному способу получения аммиака соответствует реакция:
А) NH4OH = NH3↑ +H2O Б) NH4Cl = NH3↑ +HCl↑ В) N2 + 3H2 ↔2NH3 Г) NH4Cl + NaOH = NH3↑ + H2O + NaCl |
| Ответ | Реакция «в» соответствует промышленному способу получения аммиака |











