Физические и химические свойства алкадиенов
Общая формула алкадиенов CnH2n-2
По взаимному расположению двойных связей все алкадиены подразделяют на: кумулированные (связи находятся в положениях 1 и 2) (1), сопряженные (двойные связи расположены через одну одинарную связь) (2) и изолированные (две двойные связи разделяет больше, чем одна одинарная связь –С-С-) (3):
CH2 = C = CH2 пропадиен -1,2 (1);
СН3-СН = СН-СН = СН2 пентадиен – 1,3 (2);
СН2 = СН-СН2-СН2-СН = СН-СН3 гептадиен -1,5 (3).
В молекулах алкадиенов атомы углерода находятся в sp2 гибридизации. Атом углерода, связанный двойными связями с двух сторон, имеющийся в составе кумулированных алкадиенов, находится в sp-гибридизации.
Для всех алкадиенов, начиная с пентадиена, характерна изомерия углеродного скелета (1) и изомерия положения двойных связей (2); для алкадиенов, начиная с пентадиена — 1,3, характерная цис-транс изомерия. Поскольку общая формула алкадиенов совпадает с фомудой для алкинов, следовательно, между этими классами соединений возможна межклассовая изомерия (3).
CH2 = C = CH-CH2-CH3 пентадиен – 1,2 ;
CH2 = C = C(СН3)-СН3 3-метилбутадиен – 1,2 (1).
CH2 = C = CH-CH2-CH3 пентадиен – 1,2 ;
СН3-СН = СН-СН = СН2 пентадиен – 1,3 (2).
CH2 = C = CH2 пропадиен -1,2 ;
СН≡С-СН3 пропин (3).
Химические свойства алкадиенов
Для алкадиенов характерны реакции, протекающие по механизмам электрофильного и радикального присоединения, причем, наиболее реакционноспособными являются сопряженные алкадиены.
Галогенирование. При присоединении к алкадиенам хлора или брома образуются тетрагалогеноалканы, причем, возможно образование продуктов как 1,2-, так и 1,4- присоединения. Соотношение продуктов зависит от условий проведения реакции: типа растворителя и температуры.
CH2 = CH-CH = CH2 + Br2 (гексан) → CH2(Br)-CH(Br)-CH = CH2 + CH2(Br)-CH = CH-CH2-Br
При температуре -80![]() С соотношение продуктов 1,2 – и 1,4 – присоединения – 80/20%; -15
С соотношение продуктов 1,2 – и 1,4 – присоединения – 80/20%; -15![]() С – 54/46%; +40
С – 54/46%; +40![]() С – 20/80%; +60
С – 20/80%; +60![]() С – 10/90%.
С – 10/90%.
Присоединение галогенов возможно и по радикальному механизму – под действием УФ-излучения. В этом случае также происходит образование смеси продуктов 1,2 – и 1,4 – присоединения.
Гидрогалогенирование протекает подобно галогенированию, т.е. с образованием смеси продуктов 1,2 – и 1,4 – присоединения. Соотношение продуктов в основном зависит от температуры, так, при высоких температурах преобладают продукты 1,2 – присоединения, а при низких — 1,4 – присоединения.
CH2 = CH-CH = CH2 +HBr → CH3-CH(Br)-CH = CH2 + CH3-CH = CH-CH2-Br
Реакция гидрогалогенирования может протекать в водной или спиртовой среде, в присутствии хлорида лития или в среде CHal4, где Hal – галоген.
Реакции циклоприсоединения (диеновый синтез). В таких реакциях участвуют два компонента – диен и ненасыщенное соединение – диенофил. При этом образуется замещенный шестичленный цикл. Классический пример реакции диенового синтеза – реакция взаимодействия бутадиена – 1,3 с малеиновым ангидридом:
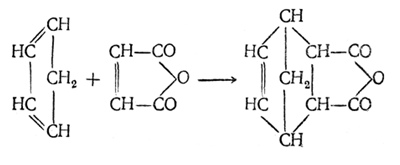
Гидрирование алкадиенов происходит в условиях жидкого аммиака и приводит к образованию смеси продуктов 1,2 – и 1,4 – присоединения:
CH2 = CH-CH = CH2 + H2 → CH3-CH2-CH = CH2 + CH3-CH = CH-CH3.
Кумулированные алкадиены способны вступать в реакции гидратации в кислой среде, т.е. присоединяют молекулы воды. При этом происходит образование неустойчивых соединений – енолов (непредельные спирты), для которых характерно явление кето-енольной таутомерии, т.е. енолы практически сразу же переходят в форму кетонов и обратно:
CH2 = C = CH2 + H2O → CH2 = C(OH)-CH3 (пропенол) ↔ СH3-C(CH3) = O (ацетон).
Реакции изомеризации алкадиенов протекают в щелочной среде при нагревании и в присутствии катализатора – оксида алюминия:
R-CH = C = C-CH-R → RC≡C-CH2-R.
Полимеризация алкадиенов может протекать как 1,2 – или 1,4 – присоединение:
nCH2 = CH-CH = CH2 → (-CH2-CH = CH-CH2-)n.
Физические свойства алкадиенов
Низшие диены — бесцветные легкокипящие жидкости. 1,3-Бутадиен и аллен (1,2 — пропадиен) — легко сжижающиеся газы, обладающие неприятным запахом. Высшие диены представляют собой твердые вещества.
Получение алкадиенов
Основные способы получения алкадиенов – дегидрирование алканов (1), реакция Лебедева (2), дегидратация гликолей (3), дегалагенирование дигалогенпроизводных (4) алкенов и реакции перегруппировки (5):
CH3-CH2-CH2-CH3 → CH2 = CH-CH = CH2 (1);
2C2H5OH → CH2 = CH-CH = CH2 + 2H2O + H2 (2);
CH3-CH(OH)-CH2-CH2-OH → CH2 = CH-CH = CH2 + 2H2O (3);
СH2 = C(Br)-CH2-Br + Zn → CH2 = C = CH2 + ZnBr2 (4);
HC≡C-CH(CH3)-CH3 + NaOH → CH2 = C = CH(CH3)-CH3 (5).
Основная сфера использования диенов и их производных – это производство каучука.
Примеры решения задач
| Задание | Какой объем водорода потребуется для каталитического гидрирования одной двойной связи диенового углеводорода (CnH2n-2) массой 5,4 г, если на бромирование такого же количества углеводорода до тетрабромида (CnH2n-2Br4) пошло 32 г брома. Каков состав углеводорода? Напишите все возможные изомеры. |
| Решение |
Запишем уравнения реакций каталитического гидрирования и бромирования алкадиена в общем виде:
CnH2n-2 + H2 → CnH2n (1) CnH2n-2 + 2Br2 → CnH2n-2Br4 (2) Молярная масса брома (молекулярная масса одного моль брома), вычисленная по таблице химических элементов Д.И. Менделеева: M(Br2) = 160 г/моль. Тогда, зная массу брома (32 г по условию задачи), можно вычислить количество вещщества брома: v(Br2) = m(Br2)/M(Br2), v(Br2) = 32/160 = 0,2 моль. По уравнению 2, 5,4 Г углеводорода – это 0,1 моль, а на гидрирование одной двойной связи его необходимо 0,1 моль водорода или 0,1×22,4 = 2,24 л водорода. Молярная масса углеводорода: M(CnH2n-2) = m(CnH2n-2)/v(CnH2n-2), M(CnH2n-2) = 5,4/0,1 = 54 г/моль. Значит, искомый углеводород – это бутадиен. Для бутадиена характерны следующие изомеры: CH2 = C = CH-CH3 бутадиен-1,2 СH2 = CH-CH = CH2 бутадиен-1,3 СH≡C-CH2-CH3 бутин-1 СН3-С≡C-СН3 бутин-2 |
| Ответ | Объем водорода – 2,24 л. Бутадиен. |
| Задание | плотность алкадиена при н.у. равна 2,41г/л. Выведите молекулярную формулу алкадиена. |
| Решение |
Известно, что количество вещества можно найти двумя способами:
v = m/M или v = V/Vm. Составим пропорцию, из которой можно выразить молярную массу вещества: M = (m×Vm)/V = ρ× Vm. Найдем молярную массу (массу одного моль) алкадиена с использованием формулы, выведенной выше: М = 2,41 × 22,4 = 54 г/моль. Общая формула алкодиенов — CnH2n-2. Выразим молярную массу алкадиена через эту формулу: М = 12n+2n-2 = 14n -2. Приравняем выражения для молярных масс: 14n -2 = 54 n = 4 Следовательно, формула алкадиена С4Н6. |
| Ответ | Формула алкадиена С4Н6. |











