Испарение и конденсация. Насыщенный и ненасыщенный пар
Испарение
В жидкости (или твердом теле) при любой температуре существует некоторое количество «быстрых» молекул, кинетическая энергия которых больше потенциальной энергии их взаимодействия с остальными частицами вещества. Если такие молекулы оказываются вблизи поверхности, то они могут преодолеть притяжение остальных молекул и вылететь за пределы жидкости, образуя над ней пар. Испарение твердых тел также часто называют возгонкой или сублимацией.
Испарение происходит при любой температуре, при которых данное вещество может находиться в жидком или твердом состояниях. Однако интенсивность испарения зависит от температуры. При повышении температуры количество «быстрых» молекул увеличивается, и, следовательно, интенсивность испарения возрастает. Скорость испарения также зависит от площади свободной поверхности жидкости от вида вещества. Так, например, вода, налитая в блюдце, испарится быстрее воды, налитой в стакан. Спирт испаряется быстрее воды и т.д.
Конденсация
Количество жидкости в открытом сосуде вследствие испарения непрерывно уменьшается. Но в плотно закрытом сосуде этого не происходит. Объясняется это тем, что одновременно с испарением в жидкости (или твердом теле) происходит обратный процесс. Молекулы пара движутся над жидкостью хаотически, поэтому часть из них под действием притяжения молекул свободной поверхности попадает обратно в жидкость. Процесс превращения пара в жидкость называется конденсацией. Процесс превращения пара в твердое тело обычно называют кристаллизацией из пара.
После того, как мы нальем жидкость в сосуд и плотно его закроем, жидкость начнет испаряться, и плотность пара над свободной поверхностью жидкости будет увеличиваться. Однако, одновременно с этим будет расти число молекул, возвращающихся обратно в жидкость. В открытом сосуде ситуация иная: покинувшие жидкость молекулы могут не возвращаться в жидкость. В закрытом сосуде с течением времени устанавливается равновесное состояние: число молекул, покидающих поверхность жидкости, становится равным числу молекул пара, возвращающихся в жидкость. Такое состояние называется состоянием динамического равновесия (рис.1). В состоянии динамического равновесия между жидкостью и паром одновременно происходит и испарение и конденсация, и оба процесса компенсируют друг друга.
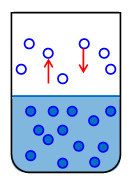
Рис.1. Жидкость в состоянии динамического равновесия
Насыщенный и ненасыщенный пар
Название «насыщенный» подчеркивает, что в данном объеме при данной температуре не может находиться большее количество пара. Насыщенный пар имеет максимальную плотность при данной температуре, а, следовательно, оказывает максимальное давление на стенки сосуда.
У разных жидкостей насыщение пара происходит при различных плотностях, что обусловлено различием в молекулярной структуре, т.е. различием сил межмолекулярного взаимодействия. В жидкостях, у которых силы взаимодействия молекул велики (например, в ртути), состояние динамического равновесия достигается при небольших плотностях пара, так как количество молекул, способных покинуть поверхность жидкости, невелико. Наоборот, у летучих жидкостей с малыми силами притяжения молекул, при тех же температурах из жидкости вылетает значительное количество молекул и насыщение пара достигается при большой плотности. Примерами таких жидкостей являются этанол, эфир и др.
Так как интенсивность процесса конденсации пара пропорциональна концентрации молекул пара, а интенсивность процесса испарения зависит только от температуры и резко возрастает с ее ростом, то концентрация молекул в насыщенном паре зависит только от температуры жидкости. Поэтому давление насыщенного пара зависит только от температуры и не зависит от объема. Причем с ростом температуры величина концентрации молекул насыщенного пара и, следовательно, плотность и давление насыщенного пара быстро растут. Конкретные зависимости давления и плотности насыщенного пара от температуры различны для разных веществ и могут быть найдены из справочных таблиц. При этом оказывается, что насыщенный пар, как правило, хорошо описывается уравнением Клайперона-Менделеева. Однако, при сжатии или нагревании масса насыщенного пара изменяется.
Ненасыщенный пар с достаточной степенью точности подчиняется законам идеального газа.
Примеры решения задач
| Задание | В закрытом сосуде вместимостью 0,5 л при температуре |
| Решение | При температуре Запишем уравнение Менделеева-Клапейрона: откуда найдем массу водяного пара: Молярная масса водяного пара определяется так же, как и молярная масса воды Универсальная газовая постоянная Переведем единицы в систему СИ: объем сосуда Вычислим: |
| Ответ | Масса водяного пара в сосуде 0,3 г. |
| Задание | В сосуде объемом 1 л при температуре |
| Решение | Запишем уравнение Менделеева-Клапейрона для газовой смеси водяной пар + азот:
откуда найдем общее количество вещества в газообразном состоянии: Универсальная газовая постоянная Переведем единицы в систему СИ: объем сосуда Вычислим: По закону Дальтона, давление в сосуде равно сумме парциальных давлений водяного пара и азота: откуда парциальное давление азота: При температуре Тогда: Запишем уравнение Менделеева — Клапейрона для водяного пара: откуда масса водяного пара: Молярная масса водяного пара Вычислим: Аналогично находим массу азота: Молярная масса азота Вычислим: |
| Ответ | Общее количество вещества в газообразном состоянии 0,097 моль; парциальное давление азота 200 кПа; масса водяного пара 0,58 г; масса азота 1,8 г. |











