Формула золота
Определение и формула золота
Он превосходит другие металлы по теплопроводности и электрической проводимости. Плотность 19,3 г/см3. Температура плавления 1064,4oC, кипения 2880oC.

Рис. 1. Золото. Внешний вид.
Химическая формула золота
Химическое обозначение золота – Au от латинского слова «aurum». Этот химический элемент расположен в шестом периоде в IВ группе Периодической таблицы Д.И. Менделеева. Относится к элементамd-семейства. Металл. Относительная атомная масса золота равна 196,9665 а.е.м.
Электронная формула золота
В ядре атома золота содержится 79 протонов и 118 нейтронов (массовое число равно 197). В атоме золота есть шесть энергетических уровня, на которых находятся 79 электронов (рис. 2).
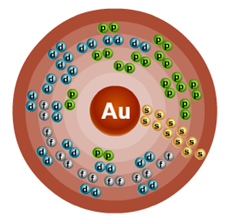
Рис. 2. Строение атома золота.
Электронная формула атома золота в основном состоянии имеет следующий вид:
+79 Au)2)8)18)32)18);
1s22s22p63s23p63d104s24p64f145s25p65d106s1.
Примеры решения задач
| Задание | При полном сгорании кислородсодержащего органического вещества массой 13,8 г получили 26,4 г углекислого газа и 16,2 г воды. Найдите молекулярную формулу вещества, если относительная плотность его паров по водороду равна 23. |
| Решение | Составим схему реакции сгорания органического соединения обозначив количество атомов углерода, водорода и кислорода за «x», «у»и «z» соответственно:
CxHyOz+ Oz→CO2 + H2O. Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м. m(C) = n(C)×M(C) = n(CO2)×M(C) = [m(CO2) / M(CO2)]×M(C); m(H) = n(H)×M(H) = 2×n(H2O)×M(H) = [2×m(H2O) / M(H2O)]×M(H); Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr): M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль; M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль. Тогда, m(C) = [26,4 / 44]×12 = 7,2 г; m(H) = 2×16,2 / 18 ×1= 1,8 г. m(O) = m(CxHyOz) – m(C) – m(H) = 13,8 – 7,2 – 1,8 = 4,8 г. Определим химическую формулу соединения: x:y:z = m(C)/Ar(C) : m(H)/Ar(H) : m(O)/Ar(O); x:y:z= 7,2/12 :1,8/1 :4,8/16; x:y:z= 0,6 : 1,8 : 0,3 = 2: 6 : 1. Значит простейшая формула соединения C2H6Oи молярную массу 46 г/моль [M(C2H6O) = 2×Ar(C) + 6×Ar(H) + Ar(O) = 2×12 + 6×1 + 16 = 24 + 6 + 16 = 46 / моль]. Значение молярной массы органического вещества можно определить при помощи его плотности по водороду: Msubstance = M(H2) × D(H2); Msubstance = 2 × 23 = 46 г/моль. Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс: Msubstance / M(C2H6O) = 46 / 46 = 1. Значит формула органического соединения будет иметь вид C2H6O. |
| Ответ | C2H6O |
| Задание | Массовая доля фосфора в одном из его оксидов равна 56,4%. Плотность паров оксида по воздуху равна 7,59. Установите молекулярную формулу оксида. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле:
ω (Х) = n × Ar (X) / M (HX) × 100%. Вычислим массовую долю кислорода в соединении: ω (O) = 100% — ω(P) = 100% — 56,4% = 43,6%. Обозначим количество моль элементов, входящих в состав соединения за «х» (фосфор), «у» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел): x:y = ω(P)/Ar(P) : ω(O)/Ar(O); x:y= 56,4/31 : 43,6/16; x:y= 1,82 : 2,725= 1 : 1,5 = 2 : 3. Значит простейшая формула соединения фосфора с кислородом будет иметь вид P2O3 и молярную массу 94 г/моль [M(P2O3) = 2×Ar(P) + 3×Ar(O) = 2×31+ 3×16 = 62 + 32 = 94 г/моль]. Значение молярной массы органического вещества можно определить при помощи его плотности по воздуху: Msubstance = Mair × Dair; Msubstance = 29 × 7,59 = 220 г/моль. Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс: Msubstance / M(P2O3) = 220 / 94 = 2. Значит индексы атомов фосфора и кислорода должны быть в 2 раза выше, т.е. формула вещества будет иметь вид P4O6. |
| Ответ | P4O6 |











