Формулы хлоридов
Определение и формулы хлоридов
Хлороводородная кислота представляет собой одноосновную кислоту, которая подвергается диссоциации в водном растворе согласно следующему уравнению:
HCl ↔ H+ + Cl—.
тем самым образуя соли – хлориды (NaCl – хлорид натрия, CaCl2– хлорид кальция, AlCl3–хлорид алюминия и т.д.).
В зависимости от типа химической связи между атомами в молекуле, различают ионные хлориды, представляющие собой твердые кристаллические вещества с высокими температурами плавления; ковалентные хлориды, представляющие собой как газообразные вещества, так и жидкости или легкоплавкие твердые вещества. Значительная часть хлоридов хорошо растворимы в воде.
Химические формулы хлоридов
Химические формулы хлоридов рассмотрим на примере NaCl – хлорида натрия, CaCl2– хлорида кальция и AlCl3–хлорида алюминия. Химическая формула показывает качественный и количественный состав молекулы (сколько и каких атомов входит в конкретное соединение) По химической формуле можно вычислить молекулярную массу хлоридов (Ar(Na) = 23а.е.м., Ar(Cl) = 35,5 а.е.м., Ar(Ca) = 40 а.е.м., Ar(Al) = 27а.е.м.):
Mr(NaCl) = Ar(Na) + Ar(Cl);
Mr(NaCl) = 23 + 35,5 = 58,5.
Mr(CaCl2) = Ar(Ca) + 2×Ar(Cl);
Mr(CaCl2) = 40 + 2×35,5 = 40 + 71 = 111.
Mr(AlCl3) = Ar(Al) + 3×Ar(Cl);
Mr(AlCl3) = 27 + 3×35,5= 27 + 106,5 = 133,5.
Структурные (графические) формулы хлоридов
Структурная (графическая) формула является более наглядной. Рассмотрим структурные формулы фосфатов на примере все тех же NaCl – хлорида натрия, CaCl2– хлорида кальция и AlCl3–хлорида алюминия.
Na — Cl
Рис. 1. Структурная формула хлорида натрия.
Cl – Ca — Cl
Рис. 2. Структурная формула хлорида кальция.
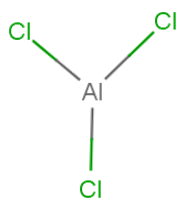
Рис. 3. Структурная формула хлорида алюминия.
Ионная формула
Хлориды представляют собой средние соли способные диссоциировать на ионы в водном растворе:
NaCl ↔ Na+ + Cl—;
CaCl2 ↔ Ca2+ + 2Cl—;
AlCl3 ↔ Al3+ + 3Cl—.
Примеры решения задач
| Задание | При полном сгорании кислородсодержащего органического вещества массой 13,8 г получили 26,4 г углекислого газа и 16,2 г воды. Найдите молекулярную формулу вещества, если относительная плотность его паров по водороду равна 23. |
| Решение | Составим схему реакции сгорания органического соединения обозначив количество атомов углерода, водорода и кислорода за «x», «у»и «z» соответственно:
CxHyOz+ Oz→CO2 + H2O. Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м. m(C) = n(C)×M(C) = n(CO2)×M(C) = [m(CO2) / M(CO2)]×M(C); m(H) = n(H)×M(H) = 2×n(H2O)×M(H) = [2×m(H2O) / M(H2O)]×M(H); Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr): M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль; M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль. Тогда, m(C) = [26,4 / 44]×12 = 7,2 г; m(H) = 2×16,2 / 18 ×1= 1,8 г. m(O) = m(CxHyOz) – m(C) – m(H) = 13,8 – 7,2 – 1,8 = 4,8 г. Определим химическую формулу соединения: x:y:z = m(C)/Ar(C) : m(H)/Ar(H) : m(O)/Ar(O); x:y:z= 7,2/12 :1,8/1 :4,8/16; x:y:z= 0,6 : 1,8 : 0,3 = 2: 6 : 1. Значит простейшая формула соединения C2H6O и молярную массу 46 г/моль [M(C2H6O) = 2×Ar(C) + 6×Ar(H) + Ar(O) = 2×12 + 6×1 + 16 = 24 + 6 + 16 = 46 / моль]. Значение молярной массы органического вещества можно определить при помощи его плотности по водороду: Msubstance = M(H2) × D(H2); Msubstance = 2 × 23 = 46 г/моль. Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс: Msubstance / M(C2H6O) = 46 / 46 = 1. Значит формула органического соединения будет иметь вид C2H6O. |
| Ответ | C2H6O |
| Задание | Молярная масса соединения азота с водородом равна 32 г/моль. Определите молекулярную формулу вещества, массовая доля азота в котором составляет 85,7%. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле:
ω (Х) = n × Ar (X) / M (HX) × 100%. Вычислим массовую долю водорода в соединении: ω (H) = 100% — ω(N) = 100% — 85,7% = 14,3%. Обозначим количество моль элементов, входящих в состав соединения за «х» (азот), «у» (водород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел): x:y = ω(N)/Ar(N) : ω(H)/Ar(H); x:y= 85,7/14 : 14,3/1; x:y= 6,12 : 14,3= 1 : 2. Значит простейшая формула соединения азота с водородом будет иметь вид NH2 и молярную массу 16 г/моль [M(NH2) = Ar(N) + 2×Ar(H) = 14+ 2×1 = 14 + 2 = 16 г/моль]. Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс: Msubstance / M(NH2) = 32 / 16 = 2. Значит индексы атомов азота и водорода должны быть в 2 раза выше, т.е. формула вещества будет иметь вид N2H4. Это гидразин. |
| Ответ | N2H4 |











