Формула хлорида меди
Определение и формула хлорида меди
Формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – представляет собой бесцветное или белое
твердое вещество с кристаллической структурой типа цинковой
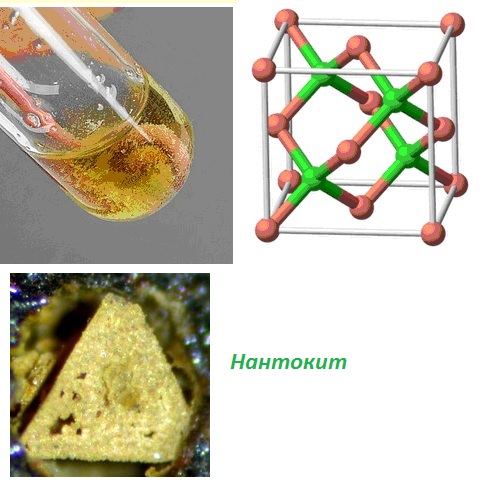
обманки ![]() , плотностью 3,7 г/см
, плотностью 3,7 г/см![]() , температура плавления
, температура плавления ![]() , т. кип.
, т. кип. ![]() ; он
устойчив в сухой атмосфере, плохо растворим в воде, эфире, ацетоне, окисляется и разлаrается на свету и во влажной атмосфере. При нагревании синеет, плавится и кипит без разложения.
; он
устойчив в сухой атмосфере, плохо растворим в воде, эфире, ацетоне, окисляется и разлаrается на свету и во влажной атмосфере. При нагревании синеет, плавится и кипит без разложения.
Известен его минерал — нантокит.
![]() впервые был получен Робертом Бойлем в середине семнадцатого века из хлорида двухвалентной ртути и металлической меди:
впервые был получен Робертом Бойлем в середине семнадцатого века из хлорида двухвалентной ртути и металлической меди:
![]()
В ![]() году Пруст охарактеризовал два различных хлорида меди. Он синтезировал
году Пруст охарактеризовал два различных хлорида меди. Он синтезировал ![]() нагреванием
нагреванием ![]() в вакууме при высокой температуре.
в вакууме при высокой температуре.
Кислый раствор ![]() ранее использовался для анализа содержания монооксида углерода в газах, например, в газовом аппарате Гемпеля в течение девятнадцатого и начале двадцатого веков.
ранее использовался для анализа содержания монооксида углерода в газах, например, в газовом аппарате Гемпеля в течение девятнадцатого и начале двадцатого веков.
Химические свойства хлорида меди
- При стоянии на воздухе при комнатной температуре в растворе окисляется:
![Rendered by QuickLaTeX.com \[ 4CuCl + O_2 + 2H_2O \rightarrow 4CuCl(OH) \downarrow green \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-1d003cfd74dde5dc180beecaf2782d13_l3.png)
- Реагирует с горячей азотной кислотой:
![Rendered by QuickLaTeX.com \[ CuCl + 3HNO_3 = Cu(NO_3)_2 + HCl + NO_2 \uparrow + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-d0d8ba99e7d6d15e6d7fc6a79eb1ff6b_l3.png)
- Образует комплексное соединение при реакции с гидратом аммиака (концентрированный раствор):
![Rendered by QuickLaTeX.com \[ CuCl + 2(NH_3 \cdot H_2O) = [Cu(NH_3)_2]Cl + 2H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-59eefdc5b5aa74c4f250b117da542f59_l3.png)
- Взаимодействует с плавиковой кислотой с образованием фторида одновалентной меди красного цвета:
![Rendered by QuickLaTeX.com \[ CuCl + HF = CuF + HCl \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-e209e7d45f23790ef9e5de71e0288bfc_l3.png)
Получение
Хлорид меди ![]() получают в промышленности путем прямого взаимодействия металлической меди и хлора при температуре выше
получают в промышленности путем прямого взаимодействия металлической меди и хлора при температуре выше ![]() :
:
![]()
Хлорид меди ![]() также можно получить восстановлением хлорида меди
также можно получить восстановлением хлорида меди ![]() , например, диоксидом серы:
, например, диоксидом серы:
![]()
Применение
Основное применение хлорида меди ![]() в качестве предшественника к фунгициду — хлорокиси меди:
в качестве предшественника к фунгициду — хлорокиси меди:
![]()
![]()
![]() катализирует различные органические реакции.
катализирует различные органические реакции.
![]() используется с окисью углерода, хлоридом алюминия и хлористым водородом в реакции Гаттермана-Коха идущей с образованием бензальдегида.
используется с окисью углерода, хлоридом алюминия и хлористым водородом в реакции Гаттермана-Коха идущей с образованием бензальдегида.
Примеры решения задач
| Задание | Определите произведение растворимости |
| Решение | Вычислим молярность раствора:
Определим произведение растворимости: |
| Ответ | |
| Задание | Рассчитайте константу равновесия получения |
| Решение | Запишем реакцию:
Запишем и рассчитаем стандартную ЭДС: Рассчитаем изменение энергии Гиббса реакции: Вычислим константу равновесия: |
| Ответ | |











