Формула сульфита натрия
Определение и формула сульфита натрия
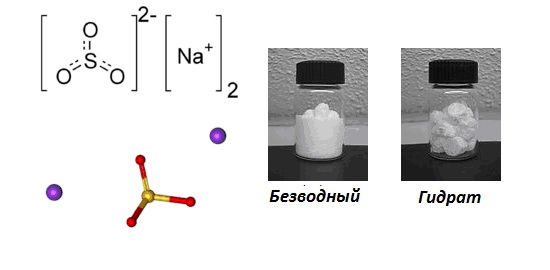
Формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – белое кристаллическое вещество, плавится без разложения под воздействием избыточного давления.
Данная соль образует кристаллогидрат с формулой ![]() .
.
Насыщенный водный раствор соли имеет ![]() . При выдержке его на воздухе, в конечном итоге он окисляется до сульфата натрия. Если сульфит натрия оставить кристаллизоваться из водного раствора при комнатной температуре или ниже, он превращается в кристаллогидрат. Безводная форма значительно устойчивее к окислению воздухом.
. При выдержке его на воздухе, в конечном итоге он окисляется до сульфата натрия. Если сульфит натрия оставить кристаллизоваться из водного раствора при комнатной температуре или ниже, он превращается в кристаллогидрат. Безводная форма значительно устойчивее к окислению воздухом.
Получение
Сульфит натрия может быть получен в лабораторных условиях путем химического взаимодействия гидроксида натрия с диоксидом серы:
![]()
Химические свойства сульфита натрия
- При нагревании до
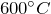 в атмосфере воздуха разлагается на сульфид натрия и сульфат натрия:
в атмосфере воздуха разлагается на сульфид натрия и сульфат натрия:
![Rendered by QuickLaTeX.com \[ 4Na_2SO_3 = Na_2S + 3Na_2SO_4 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-b262c9341a8ac9ec86c036e2f9b3c202_l3.png)
- При нагревании кристаллогидрата до
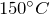 он разлагается на безводную соль и семь молекул воды:
он разлагается на безводную соль и семь молекул воды:
![Rendered by QuickLaTeX.com \[ Na_2SO_3 \cdot 7H_2O = Na_2SO_3 + 7H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-d99a975715b6060abb96a8ff12dd83ae_l3.png)
- Отлично растворяется в воде (протекает гидролиз по аниону):
![Rendered by QuickLaTeX.com \[ Na_2SO_3_{(dilute)} + 8H_2O = 2[Na(H_2O)_4]^+ + SO_3^{2-} \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-cd786c2dd216331c175cb397b0d199da_l3.png)
![Rendered by QuickLaTeX.com \[ SO_3^{2-} + H_2O \rightleftharpoons HSO_3^- + OH^- \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-22f2091da810ef5d65a22b8a037f0118_l3.png)
- Разлагается кислотами, не проявляющими окислительных свойств:
![Rendered by QuickLaTeX.com \[ Na_2SO_3 + 2HCl = 2NaCl + SO_2 \uparrow + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-2b945a63d96aa51985a3fdf8c2aebcbe_l3.png)
- Проявляет сильные восстановительные свойства:
![Rendered by QuickLaTeX.com \[ Na_2SO_3 + 2NaOH + Br_2 = Na_2SO_4 + 2NaBr + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-a0713777a9d6b55ceaf1660369a52343_l3.png)
![Rendered by QuickLaTeX.com \[ Na_2SO_3 + H_2O + 2AgNO_3 = Na_2SO_4 + 2Ag \downarrow + 2HNO_3 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-e1168addb13ac31e05a5950a629c35bc_l3.png)
![Rendered by QuickLaTeX.com \[ 5Na_2SO_3 + 3H_2SO_4 + KMnO_4 = 5Na_2SO_4 + 2MnSO_4 + 3H_2O + K_2SO_4 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-50d9886b1e8f60e0207e5a93b5dec68c_l3.png)
Применение
Сульфит натрия в основном используется в целлюлозно-бумажной промышленности. Он находит применение в обработке воды в качестве кислород очищающего агента, для очистки воды, подаваемой в паровые котлы, для избежания проблем с коррозией, в фотографической промышленности для защиты решений разработчиков от окисления, в текстильной промышленности в качестве отбеливающего, обессеривающего и дехлорирующего агента. Он используется в химическом производстве как сульфирующий и сульфометилирующий агент. Он применяется в производстве тиосульфата натрия.
Примеры решения задач
| Задание | Рассчитайте молярную массу эквивалента |
| Решение | Запишем уравнение химической реакции, в соответствии с протекающим процессом:
Запишем полуреакцию окисления и восстановления и определим фактор эквивалентности Рассчитаем фактор эквивалентности Определим молярную массу эквивалента |
| Ответ |
| Задание | Какова массовая доля элементов в |
| Решение | Пусть имеется В Определим массу элементов в Рассчитаем массовую долю элементов. |
| Ответ | |











