Формула сульфита калия
Определение и формула сульфита калия

Формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – белые кристаллы разлагающиеся при нагревании.
Образует кристаллогидрат с формулой ![]() .
.
В воде протекает гидролиз по аниону, поскольку соль образована сильным основанием и слабой кислотой.
Известно, что пищевая добавка ![]() (сульфит калия) приводит к уничтожению в организме витамина
(сульфит калия) приводит к уничтожению в организме витамина ![]() и
и ![]() , которые полезны для нервной системы. Со временем может появиться головокружение, бессонница.
, которые полезны для нервной системы. Со временем может появиться головокружение, бессонница.
Получение
Сульфит калия обычно получают при взаимодействии карбоната калия и оксида серы ![]() :
:
![]()
Химические свойства сульфита калия
- При нагревании до
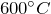 разлагается на сульфид калия и сульфат калия:
разлагается на сульфид калия и сульфат калия:
![Rendered by QuickLaTeX.com \[ 4K_2SO_3 = K_2S + 3K_2SO_4 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-68aacc7faaa997e7c31b8b01b2a55619_l3.png)
- При нагревании кристаллогидрата до
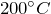 он разлагается на безводную соль и молекулу воды:
он разлагается на безводную соль и молекулу воды:
![Rendered by QuickLaTeX.com \[ K_2SO_3 \cdot H_2O = K_2SO_3 + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-5da9b9e68cd3d3aa0275ca88c5b2dcea_l3.png)
- Растворяется в воде (гидролиз по аниону):
![Rendered by QuickLaTeX.com \[ K_2SO_3_{(dilute)} + 12H_2O = 2[K(H_2O)_6]^+ + SO_3^{2-} \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-a857f1ae33c5da404d13e04b8ecc92fe_l3.png)
![Rendered by QuickLaTeX.com \[ SO_3^{2-} + H_2O \rightleftharpoons HSO_3^- + OH^- \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-22f2091da810ef5d65a22b8a037f0118_l3.png)
- Разлагается кислотами-неокислителями:
![Rendered by QuickLaTeX.com \[ K_2SO_3 + 2HCl = 2KCl + SO_2 \uparrow + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-e929caf41a2b2d58c89428ffbc3254d3_l3.png)
- Проявляет сильные восстановительные свойства:
![Rendered by QuickLaTeX.com \[ K_2SO_3 + K_2S + I_2 = K_2SO_3S + 2KI \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-9402d390f3d4bfbba5d36b2668b0a8da_l3.png)
![Rendered by QuickLaTeX.com \[ K_2SO_3 + S = K_2SO_3S \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-bdbd1ae3f23713b1099736f2e42b032c_l3.png)
![Rendered by QuickLaTeX.com \[ 3K_2SO_3 + 4H_2SO_4 + K_2Cr_2O_7 = 4K_2SO_4 + Cr_2(SO_4)_3 + 4H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-f368c01fe9001eff6ff4431feb91b615_l3.png)
Применение
Используется в качестве консерванта как пищевая добавка ![]() .
.
Примеры решения задач
| Задание | Найдите массу |
| Решение | Запишем реакцию взаимодействия карбоната калия и диоксида серы:
В состоянии равновесия число моль необходимых для расчета веществ равны (в моль): Вычислим изменение энергии Гиббса реакции: Рассчитаем константу равновесия при Запишем равновесие: Так как Рассчитаем массу |
| Ответ |
| Задание | Какую массу |
| Решение | Запишем диссоциацию и гидролиз соли:
Равновесные концентрации частиц (в моль): Определим константу гидролиза: Рассчитаем исходную концентрацию Найдем массу |
| Ответ |






![Rendered by QuickLaTeX.com \[ C_0 = \frac{x^2 + K \cdot x}{K} = \frac{[OH^-]^2 + K \cdot [OH^-]}{K} = \frac{\frac{K_W^2(H_2O)}{[H^+]^2} + \frac{K \cdot K_W(H_2O)}{[H^+]}}{\frac{K}{1}} = \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-97c54716bbf5ed31ff7074256c3f4d62_l3.png)





