Формула сернистого газа
Определение и формула сернистого газа
Растворимость оксида серы (IV) в воде весьма велика (при обычных условиях около 40 объемов SO2 на один объем воды). Водный раствор диоксида серы называется сернистой кислотой.
Химическая формула сернистого газа
Химическая формула сернистого газа – SO2. Она показывает, что в составе молекулы этого сложного вещества находится один атом серы (Ar = 32 а.е.м.) и два атома кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу сернистого газа:
Mr(SO2) = Ar(S) + 2×Ar(O) = 32 + 2×16 = 32 + 32 = 64
Структурная (графическая) формула сернистого газа
Более наглядной является структурная (графическая) формула сернистого газа. Она показывает то, как связаны атомы между собой внутри молекулы. Строение молекулы SO2 (рис. 1) аналогично строению молекулы озона O3 (OO2), но молекула отличается высокой термической устойчивостью.
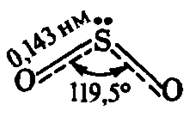
Рис. 1. Строение молекулы сернистого газа с указанием валентных углов между связями и длин химических связей.
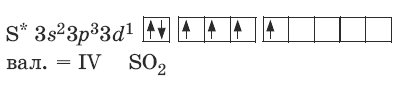
Электронные формулы
Электронные формулы, показывающие распределение электронов в атоме по энергетическим подуровням принято изображать только для отдельных химических элементов, однако для сернистого газа можно представить и такую формулу:
Примеры решения задач
| Задание | В состав вещества входит 32,5% натрия, 22,5% серы и 45% кислорода. Выведите химическую формулу вещества. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле:
ω (Х) = n × Ar (X) / M (HX) × 100% Обозначим количество моль элементов, входящих в состав соединения за «х» (натрий), «у» (сера) и «z» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел): x:y:z = ω(Na)/Ar(Na) : ω(S)/Ar(S) : ω(O)/Ar(O); x:y:z= 32,5/23 : 22,5/32 : 45/16; x:y:z= 1,4 : 0,7: 2,8 = 2 : 1: 4 Значит формула соединения натрия, серы и кислорода будет иметь вид Na2SO4. Это сульфат натрия. |
| Ответ | Na2SO4 |
| Задание | Магний соединяется с азотом, образуя нитрид магния, в массовом соотношении 18:7. Выведите формулу соединения. |
| Решение | Для того, чтобы узнать, в каких отношениях находятся химические элементы в составе молекулы необходимо найти их количество вещества. Известно, что для нахождения количества вещества следует использовать формулу:
n = m / M Найдем молярные массы магния и азота (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел). Известно, что M = Mr, значит M(Mg) = 24 г/моль, а М(N) = 14 г/моль. Тогда, количество вещества этих элементов равно: n (Mg) = m (Mg) / M (Mg); n (Mg) = 18 / 24 = 0,75 моль n (N) = m (N) / M (N); n (N) = 7 / 14 = 0,5 моль Найдем мольное отношение: n(Mg) :n(N) = 0,75: 0,5 = 1,5 :1 = 3:2, т.е. формула соединения магния с азотом имеет вид Mg3N2. |
| Ответ | Mg3N2 |











