Формула простого эфира
Определение и формула простого эфира
Химическая формула – ![]() , где
, где ![]() – это углеводородный радикал.
– это углеводородный радикал.
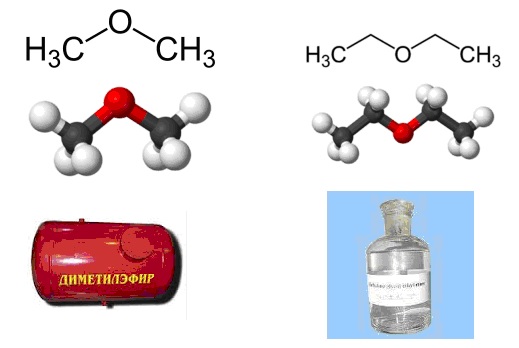
Низшие представители имеют следующие формулы:
![]()
![]()
![]()
Молярная масса:
![]() г/моль
г/моль
![]() г/моль
г/моль
Физические свойства – ![]() и
и ![]() являются газами, остальные подвижные легкокипящие жидкости. Эфиры плохо растворимы в воде, легче воды, имеют приятный запах.
являются газами, остальные подвижные легкокипящие жидкости. Эфиры плохо растворимы в воде, легче воды, имеют приятный запах.
Химические свойства простого эфира
- Простые эфиры являются достаточно инертными соединениями, они не подвергаются гидролизу, не разлагаются водой, не взаимодействуют со щелочами и не расщепляются щелочными металлами на холоду. Простые эфиры имеют слабую основность, поэтому реагируют с разбавленными кислотами, некоторые концентрированные кислоты могут расщеплять простые эфиры, металлический натрий также расщепляет простые эфиры при нагревании:
![Rendered by QuickLaTeX.com \[ R_1-O-R_2 + HCl \rightarrow [R_1-OH-R_2]Cl \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-fe5f3a2eefe9ef70868cb7bdfb1a903b_l3.png)
![Rendered by QuickLaTeX.com \[ R_1-O-R_2 + H_2SO_4 \rightarrow R_1-O-SO_3H + R_2-OH \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-36d57988f0aa2cdfa62255cbd2b00cb2_l3.png)
![Rendered by QuickLaTeX.com \[ R_1-O-R_2 + HI \rightarrow R_1-I + R_2-OH \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-62b8e1db275d669f2eec9f8bb6154871_l3.png)
![Rendered by QuickLaTeX.com \[ R_1-O-R_2 + 2Na \rightarrow R_1-Na + R_2-ONa \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-1fe257ff262e1d49d974d658cdca6ded_l3.png)
Получение
Реакция галогенпроизводных углеводородов с алкоголятами (реакция Вильямсона):
![]()
Дегидратация спиртов под действием сильных минеральных кислот при нагревании до ![]() :
:
![]()
Применение
В основном простые эфиры применяются как растворители или в качестве реакционной среды для проведения химических реакций.
Примеры решения задач
| Задание | Каково изменение энергии Гиббса при испарении диметилового эфира при |
| Решение | Запишем схему процесса испарения:
Запишем выражение для константы равновесия: Из литературы J.Chem.Eng.Data 2004, 49, 32 — 34 известно, что при Рассчитаем изменение энергии Гиббса. |
| Ответ |
| Задание | Сколько простого эфира можно получить из 1 моль соответствующего спирта, если константа равновесия равна единице? |
| Решение | Запишем реакцию и константу равновесия:
Равновесные концентрации частиц, участвующих в реакции: Здесь |
| Ответ |











