Формула природного газа
Определение и формула природного газа
Так, например, газ Ставропольского месторождения содержит 97,7% метана и 2,3% прочих газов, газ Саратовского месторождения – 93,4% метана, 3,6% этана, пропана, бутана и 3% негорючих газов.
К природным газам относятся и так называемые попутные газ, которые обычно растворены в нефти и выделяются при её добыче. В попутных газах содержится меньше метана, но больше этана, пропана, бутана и других высших углеводородов. Кроме того, в них присутствуют в основном те же примеси, что и в других природных газах, не связанных с залежами нефти, а именно: сероводород, азот, благородные газы, пары воды, углекислый газ.
Поскольку в природном газе содержится более 90% метана, то рассмотрим формулу именно этого соединения.
Химическая формула природного газа
Химическая формула метана CH4. Она показывает, что в состав данной молекулы входят один атом углерода (Ar = 12 а.е.м.) и четыре атома водорода (Ar = 1 а.е.м.). По химической формуле можно вычислить молекулярную массу метана:
Mr(CH4) = Ar(C) + 4×Ar(H);
Mr(CH4) = 12 + 4×1 = 12 + 4 = 16
Графическая (структурная) формула природного газа
Структурная (графическая) формула метана является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы (рис. 1).
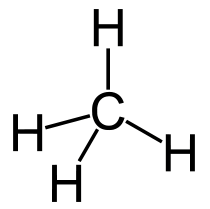
Рис. 1. Графическая формула метана.
Атом углерода в молекуле метана находится в sp3 –гибридизации. Углы между связями в молекуле метана равны 109,50 (рис. 2).
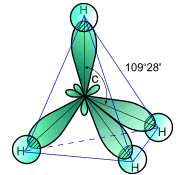
Рис. 2. Пространственное изображение молекулы метана.
Электронная формула природного газа
Молекула метана в общем виде соответствует формуле AB4. Центральный атом – атом углерода, атомы водорода – лиганды. Запишем электронную конфигурацию атома углерода в основном состоянии и зарисуем его электронно-графическую формулу:
6С 1s22s22p2
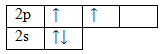
Чтобы принять четыре атома водорода, атому углерода необходимо перейти в возбужденное состояние:
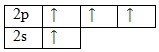
Аналогичные операции произведем для атома водорода:
1H 1s1

Примеры решения задач
| Задание | При сгорании 7 г органического вещества получили 11,2 л (н.у.) CO2 и 9 г H2O. Относительная плотность вещества по кислороду равна 1,313. Найдите молекулярную формулу вещества. |
| Решение | Составим схему реакции сгорания органического соединения обозначив количество атомов углерода, водорода и кислорода за «x», «у»и «z» соответственно:
CxHyOz →CO2 + H2O Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м. m(C) = n(C)×M(C) = n(CO2)×M(CO2) = [V(CO2) / Vm]×M(CO2); m(H) = n(H)×M(H) = 2×n(H2O)×M(H) = [2×n(H2O) / M(H2O)]×M(H) Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr): M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль; M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль Тогда, m(C) = [11,2 / 22,4]×44 = 6 г; m(H) = [2×9 / 18] ×1 = 1 г Определим химическую формулу соединения как CxHy: x:y = m(C)/Ar(C) : m(H)/Ar(H); x:y =6/12 :1/1; x:y = 0,5 : 1 = 1: 2 Значит простейшая формула соединения CH2и молярную массу 14 г/моль [M(CH2) = Ar(C) + 2×Ar(H)= 12 + 2×1 = 14 г/моль]. Значение молярной массы органического вещества можно определить при помощи его плотности по кислороду: Msubstance = M(O2) × D(O2); Msubstance = 32 × 1,313 = 42 г/моль Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс: Msubstance / M(CH2) = 42 / 14 = 3 Значит индексы атомов углерода и водорода должны быть в 3 раза выше, т.е. формула вещества будет иметь вид C3H6. |
| Ответ | C3H6 |
| Задание | Найдите молекулярную формулу вещества, если плотность его паров по водороду равна 67,5, а состав выражается следующими массовыми долями элементов: 23,7% серы, 23,7% кислорода, 52,6% хлора. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле:
ω (Х) = n × Ar (X) / M (HX) × 100% Обозначим количество моль элементов, входящих в состав соединения за «х» (сера), «у» (хлор) и «z» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел): x:y:z = ω(S)/Ar(S) : ω(Cl)/Ar(Cl) : ω(O)/Ar(O); x:y:z= 23,7/32 : 52,6/35,5 : 23,7/16; x:y:z= 0,74 : 1,48:1,48 = 1 : 2: 2 Значит простейшая формула соединения серы, хлора и кислорода будет иметь вид SCl2O2 и молярную массу 135г/моль[M(SCl2O2) = Ar(S) + 2×Ar(Cl) + 2×Ar(O) = 32 + 2×35,5 + 2×16 = 32 + 71 + 32 = 135г/моль]. Значение молярной массы органического вещества можно определить при помощи его плотности по водороду: Msubstance = M(H2) × D(H2); Msubstance = 2 × 67,5 = 135 г/моль Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс: Msubstance / M(SCl2O2) = 135 / 135 = 1 Значит формула соединения серы, хлора и кислорода имеет вид SCl2O2. |
| Ответ | SCl2O2 |











