Формула ортофосфорной кислоты
Определение и формула ортофосфорной кислоты
Плавится без разложения (42,35oC). В жидком состоянии склонна к переохлаждению, при умеренном нагревании разлагается. Хорошо растворяется в воде. Является слабой кислотой.

Рис. 1. Ортофосфорная кислота. Внешний вид.
Химическая формула ортофосфорной кислоты
Химическая формула ортофосфорной кислоты H3PO4. Она показывает, что в состав данной молекулы входят три атома водорода (Ar = 1 а.е.м.), один атом фосфора (Ar = 31 а.е.м.) и четыре атома кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу ортофосфорной кислоты:
Mr(H3PO4) = 3×Ar(H) + Ar(P) + 4×Ar(O);
Mr(H3PO4) = 3×1 + 31 + 4×16= 3 + 31 + 64 = 98
Графическая (структурная) формула ортофосфорной кислоты
Структурная (графическая) формула ортофосфорной кислоты является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы:
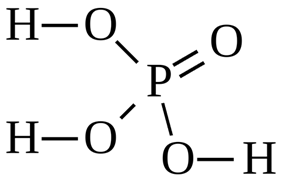
В зависимости от того, в каком агрегатном состоянии находится ортофосфорная кислота, её молекула может принимать в пространстве различную форму. Например, в газовой фазе это тетраэдр (рис. 2), а в кристаллической форме – молекулы состава PO(OH)3, которые связаны между собой водородными связями в двухмерные слои.
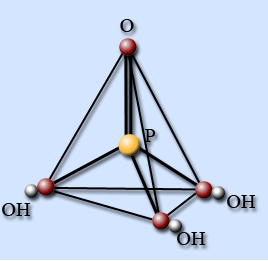
Рис. 2. Пространственное строение молекулы ортофосфорной кислоты.
Ионная формула
Ортофосфорная кислота представляет собой трехосновную кислоту, которая подвергается ступенчатой диссоциации в водном растворе согласно следующим уравнениям реакции:
H3PO4 ↔ H+ + H2PO4—;
H2PO4— ↔ H+ + HPO42-;
HPO42- ↔ H+ + PO43-
Примеры решения задач
| Задание | При сгорании 7 г органического вещества получили 11,2 л (н.у.) CO2 и 9 г H2O. Относительная плотность вещества по кислороду равна 1,313. Найдите молекулярную формулу вещества. |
| Решение | Составим схему реакции сгорания органического соединения обозначив количество атомов углерода, водорода и кислорода за «x», «у»и «z» соответственно:
CxHyOz →CO2 + H2O Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м. m(C) = n(C)×M(C) = n(CO2)×M(CO2) = [V(CO2) / Vm]×M(CO2); m(H) = n(H)×M(H) = 2×n(H2O)×M(H) = [2×n(H2O) / M(H2O)]×M(H) Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr): M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль; M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль Тогда, m(C) = [11,2 / 22,4]×44 = 6 г; m(H) = [2×9 / 18] ×1 = 1 г Определим химическую формулу соединения как CxHy: x:y = m(C)/Ar(C) : m(H)/Ar(H); x:y =6/12 :1/1; x:y = 0,5 : 1 = 1: 2 Значит простейшая формула соединения CH2и молярную массу 14 г/моль [M(CH2) = Ar(C) + 2×Ar(H)= 12 + 2×1 = 14 г/моль]. Значение молярной массы органического вещества можно определить при помощи его плотности по кислороду: Msubstance = M(O2) × D(O2); Msubstance = 32 × 1,313 = 42 г/моль Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс: Msubstance / M(CH2) = 42 / 14 = 3 Значит индексы атомов углерода и водорода должны быть в 3 раза выше, т.е. формула вещества будет иметь вид C3H6. |
| Ответ | C3H6 |
| Задание | Найдите молекулярную формулу вещества, если плотность его паров по водороду равна 67,5, а состав выражается следующими массовыми долями элементов: 23,7% серы, 23,7% кислорода, 52,6% хлора. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле:
ω (Х) = n × Ar (X) / M (HX) × 100% Обозначим количество моль элементов, входящих в состав соединения за «х» (сера), «у» (хлор) и «z» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел): x:y:z = ω(S)/Ar(S) : ω(Cl)/Ar(Cl) : ω(O)/Ar(O); x:y:z= 23,7/32 : 52,6/35,5 : 23,7/16; x:y:z= 0,74 : 1,48:1,48 = 1 : 2: 2 Значит простейшая формула соединения серы, хлора и кислорода будет иметь вид SCl2O2 и молярную массу 135г/моль[M(SCl2O2) = Ar(S) + 2×Ar(Cl) + 2×Ar(O) = 32 + 2×35,5 + 2×16 = 32 + 71 + 32 = 135г/моль]. Значение молярной массы органического вещества можно определить при помощи его плотности по водороду: Msubstance = M(H2) × D(H2); Msubstance = 2 × 67,5 = 135 г/моль Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс: Msubstance / M(SCl2O2) = 135 / 135 = 1 Значит формула соединения серы, хлора и кислорода имеет вид SCl2O2. |
| Ответ | SCl2O2 |











