Формула оксида хлора
Определение и формула оксида хлора
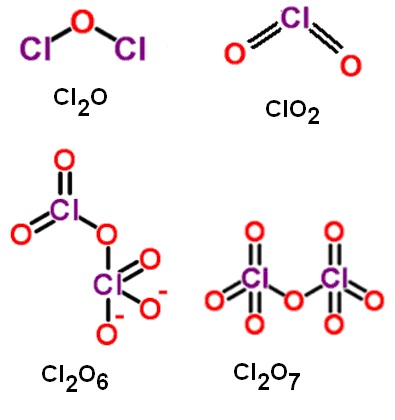
Химическая формула – ![]() , где
, где ![]() может изменяться от 1 до 2, а
может изменяться от 1 до 2, а ![]() — от 1 до 7.
— от 1 до 7.
Молярная масса:
![]() г/моль
г/моль
![]() г/моль
г/моль
![]() г/моль
г/моль
![]() г/моль
г/моль
![]() г/моль
г/моль
Физические свойства:
![]() – это газ буровато-жёлтого цвета с запахом, который похож на запах хлора, при
– это газ буровато-жёлтого цвета с запахом, который похож на запах хлора, при ![]() конденсируется в золотисто-красную жидкость, при
конденсируется в золотисто-красную жидкость, при ![]() отвердевает, растворимость в воде равна 143 г/100 мл, плотность при нормальных условиях 3,22 г/л.
отвердевает, растворимость в воде равна 143 г/100 мл, плотность при нормальных условиях 3,22 г/л.
![]() – это газ красновато-жёлтого цвета со специфическим запахом, при
– это газ красновато-жёлтого цвета со специфическим запахом, при ![]() конденсируется в красно-коричневую жидкость, при
конденсируется в красно-коричневую жидкость, при ![]() отвердевает, растворим в воде, плотность жидкости 1,653 г/см
отвердевает, растворим в воде, плотность жидкости 1,653 г/см![]() при
при ![]() .
.
![]() – это жидкость ярко-красного цвета, при
– это жидкость ярко-красного цвета, при ![]() отвердевает в оранжевые кристаллы, при
отвердевает в оранжевые кристаллы, при ![]() кипит.
кипит.
![]() – это маслянистая жидкость не имеющая цвета, при
– это маслянистая жидкость не имеющая цвета, при ![]() отвердевает, при
отвердевает, при ![]() кипит, при
кипит, при ![]() разлагается.
разлагается.
Химические свойства оксида хлора
Оксиды хлора являются окислителями, поэтому реагируют с восстановителями, некоторые могут диспропорционировать и разлагаться, при растворении в воде и щелочах образуют соответствующие кислоты и соли, так как являются кислотными оксидами.
- Свойства
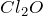 :
:
![Rendered by QuickLaTeX.com \[ 2Cl_2O = 2Cl_2 + O_2 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-ff8f5356261f3d54067699f3dbb570a6_l3.png)
![Rendered by QuickLaTeX.com \[ 4Cl_2O = 3Cl_2 + 2ClO_2 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-a262a1665f2de852d2bcaf5441318be9_l3.png)
![Rendered by QuickLaTeX.com \[ Cl_2O + H_2O = 2HClO \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-e408c771de28b24033d7765621594ff6_l3.png)
![Rendered by QuickLaTeX.com \[ Cl_2O + 2NaOH = 2NaClO + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-16d35d4be8efce2524bbf924a440f45a_l3.png)
- Свойства
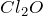 :
:
![Rendered by QuickLaTeX.com \[ 6ClO_2 = 4ClO_3 + Cl_2 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-5361dff21c3e4c4a881928ed3f3b512f_l3.png)
![Rendered by QuickLaTeX.com \[ 2ClO_2 = Cl_2 + 2O_2 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-6a1701a42ed049006bc146fbf65973f9_l3.png)
![Rendered by QuickLaTeX.com \[ 2ClO_2 + H_2O = HClO_2 + HClO_3 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-e5248b29fa9ab73b5b6d667b4955de3a_l3.png)
![Rendered by QuickLaTeX.com \[ ClO_2 + 2NaOH = NaClO_2 + NaClO_3 + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-0a1571dc5aa3b23616f4be30ee12b6ee_l3.png)
![Rendered by QuickLaTeX.com \[ 2ClO_2 + 8HCl = 5Cl_2 + 4H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-3dd4fa59932d1ef4ccb4f93ca7dc8f80_l3.png)
- Свойства
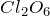 :
:
![Rendered by QuickLaTeX.com \[ Cl_2O_6 = 2ClO_2 + O_2 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-71fc5922be913c399fd1864a08f9badb_l3.png)
![Rendered by QuickLaTeX.com \[ Cl_2O_6 + H_2O = HClO_3 + HClO_4 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-e60db8ab346d4287bada6857e6f0e3a9_l3.png)
![Rendered by QuickLaTeX.com \[ Cl_2O_6 + 2NaOH = NaClO_3 + NaClO_4 + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-d9cc2a94409df7be1bb041e8cf9ddb54_l3.png)
- Свойства
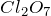 :
:
![Rendered by QuickLaTeX.com \[ 2Cl_2O_7 = 2Cl_2 + 7O_2 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-5a38da82fe10e67037fb919b60fa1eab_l3.png)
![Rendered by QuickLaTeX.com \[ Cl_2O_7 + H_2O = 2HClO_4 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-8d37c46204f275a6993939a405ad9a8e_l3.png)
![Rendered by QuickLaTeX.com \[ Cl_2O_7 + 2NaOH = 2NaClO_4 + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-b3fc35be67329b8a3849e4920b5acfbd_l3.png)
Получение
Получение 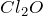
Промышленный способ получения ![]() :
:
![]()
В лаборатории ![]() получают по методу Пелуза:
получают по методу Пелуза:
![]()
Получение 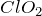
Промышленный способ получения ![]() :
:
![]()
Лабораторный способ получения ![]() :
:
![]()
Получение 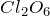
Общий способ получения ![]() :
:
![]()
Получение 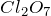
Общий способ получения ![]() :
:
![]()
Применение
Оксиды хлора применяются в качестве отбеливателей, получения солей, соответствующих кислот.
Примеры решения задач
| Задание | Во сколько раз связь |
| Решение | Вычислим изменение энтальпии следующих реакций:
Рассчитаем энергию связи Найдем отношение энергий связи: |
| Ответ |
| Задание | В газовой фазе смешивают |
| Решение | Рассмотрим уравнение химического взаимодействия:
Равновесные концентрации участников реакции: Определим начальное количество вещества Рассчитаем изменение энергии Гиббса и константу равновесия реакции: Так как в ходе реакции число моль не изменяется, то константа, выраженная через парциальные давления
Рассчитаем число моль каждого вещества: |
| Ответ |











