Формула оксида углерода
Определение и формула оксида углерода
Углерод образует два оксида – оксид углерода (II) и оксид углерода (IV) (углекислый газ).
Оксид углерода (II)
Оксид углерода (II) (монооксид углерода, угарный газ, окись углерода)
Химическая формула: CO.

Молярная масса: 28,01 г/моль
В молекуле оксида углерода (II) две связи образованы по обменному механизму за счет неспаренных электронов атомов углерода и кислорода.Но у атома кислорода есть еще неподеленная пара электронов на 2р-орбитали, а у атома углерода – свободная 2р-орбиталь. Пара электронов переходит от атома кислорода к атому углерода, образуя еще одну связь по донорно-акцепторному механизму.
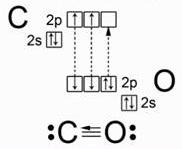
Молекула оксида углерода (II) слабо поляризована, причем электронная плотность смещена к атому углерода: C−←O+. Из-за наличия тройной связи молекула весьма прочная и имеет небольшое межъядерное расстояние.
При нормальных условиях оксид углерода (II) – газ без цвета, вкуса и запаха. Горючий. Мало растворим в воде.
Оксид углерода (II) – несолеобразующий оксид.
Химические свойства оксида углерода (II)
При стандартной температуре оксид углерода (II) малоактивен, химическая активность резко повышается пр и повышении температуры и в растворах.
Основные типы химических реакций оксида углерода (II):
- реакции присоединения:
![Rendered by QuickLaTeX.com \[ CO + Cl_{2} \to COCl_{2} \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-857d913ded3f705536a53d883d6ce291_l3.png)
![Rendered by QuickLaTeX.com \[ CO + S \to COS \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-d4d9162add547f4e7f36788d49f31f17_l3.png)
- окислительно-восстановительные реакции, оксида углерода (II) играет роль восстановителя:
![Rendered by QuickLaTeX.com \[ Fe_{2}O_{3} + 3CO \to 2Fe + 3CO_{2} \uparrow \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-ab39da51fbcdcce97e45e6d63cec4661_l3.png)
![Rendered by QuickLaTeX.com \[ CO + CuO \to Cu + CO_{2} \uparrow \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-8641b1458c73cf16a83f0abccc697c20_l3.png)
Такие реакции широко применяются в металлургии.
Очень важной с практической точки зрения является реакция оксида углерода (II) с водородом с образованием разнообразных органических соединений:
xCO + yH2 ![]() спирты + линейные алканы.
спирты + линейные алканы.
Оксид углерода (II) – токсичный газ. Попадая при дыхании в кровь, он быстро соединяется с гемоглобином, образуя карбоксигемоглобин – прочный карбонильный комплекс, более прочный, чем комплекс гемоглобина с кислородом, тем блокируя процессы транспорта кислорода и клеточного дыхания. Содержание в воздухе более 0,1% угарного газа может привести к потере сознания и смерти.
Примеры решения задач
| Задание | Какой объем оксида углерода (II) использовался для восстановления оксида железа (III), если в результате было пол учено 11,2 г железа, а выход реакции составил 80% от теоретически возможного? |
| Решение | Запишем уравнение реакции:
Рассчитаем теоретическую массу полученного железа:
Количество вещества железа равно:
По уравнению реакции
Рассчитаем объем оксида углерода (II):
|
| Ответ | Объем оксида углерода (II) равен 8,4л. |
| Задание | 3л смеси оксида углерода (II) и оксида углерода (IV) пропустили сквозь раскаленный древесный уголь, в результате объем смеси увеличился до 5л (при тех же условиях). Определите исходный состав смеси. |
| Решение | Запишем уравнение реакции. С раскаленным углем будет взаимодействовать только оксида углерода(IV):
По уравнению реакции Следовательно, объем образовавшегося оксида углерода(II) равен:
Исходный объем смеси равен:
Конечный объем смеси равен:
Составим систему уравнений: 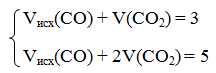
Если их второго уравнения вычесть первое, получим
Следовательно
|
| Ответ | В смеси было 1л оксида углерода(II) и 2л оксида углерода (IV). |











