Формула оксида серы
Определение и формула оксида серы
Сера образует два оксида, в которых проявляет валентности IV и VI и степени окисления (+4) и (+6). Рассмотрим каждый из них более подробно.
Растворимость оксида серы (IV) в воде весьма велика (при обычных условиях около 40 объемов SO2 на один объем воды). Водный раствор диоксида серы называется сернистой кислотой.
Разлагается при высоких температурах. В твердом состоянии существует в виде аморфного летучего тримера S3O9, цепного слоистого и сетчатого полимеров (SO3)n; ниже 25oC тример переходит в полимер. Хорошо растворяется в безводной серной кислоте. Проявляет кислотные свойства.
Химическая формула оксида серы
Химическая формула оксида серы (IV) SO2, а оксида серы (VI) – SO3. Химическая формула показывает качественные и количественный состав молекулы (сколько и каких атомов присутствует в ней). По химической формуле можно вычислить молекулярную массу вещества:
Mr(SO2) = Ar(S)+ 2×Ar(O);
Mr(SO2) = 32 + 2×16 = 32 + 32 = 64
Mr(SO3) = Ar(S)+ 3×Ar(O);
Mr(SO3) = 32 + 3×16 = 32 + 48 = 80
Структурная (графическая) формула оксида серы
Структурная (графическая) формула вещества является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы.
Строение молекулы SO2 (рис. 1) аналогично строению молекулы озона O3 (OO2), но молекула отличается высокой термической устойчивостью.
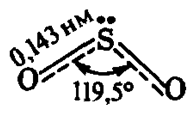
Рис. 1. Строение молекулы диоксида серы с указанием валентных углов между связями и длин химических связей.
В газообразном состоянии оксид серы (VI) имеет плоское тригональное строение (рис. 2), однако при переходе в жидкое или кристаллическое состояние происходит образование циклического тримера и загзагообразных цепей.
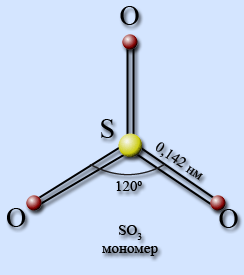
Рис. 2. Строение молекулы оксида серы (VI) с указанием валентного угла и длины химической связи.
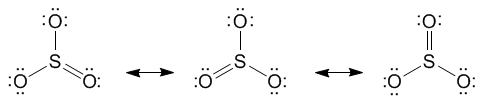
Электронная формула
Электронное строение оксидов серы показано ниже (а – оксид серы (IV), б – оксид серы (VI)):
а)
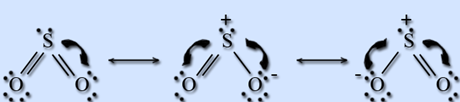
б)
Примеры решения задач
| Задание | При полном сгорании 6 г органического вещества образовалось 8,8 г оксида углерода (IV) и 3,6 г воды. Определите молекулярную формулу сожженного вещества, если известно, что его молярная масса равна 180 г/моль. |
| Решение | Составим схему реакции сгорания органического соединения обозначив количество атомов углерода, водорода и кислорода за «x», «у»и «z» соответственно:
CxHyOz+ Oz→CO2 + H2O Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м. m(C) = n(C)×M(C) = n(CO2)×M(C) = [m(CO2) / M(CO2)]×M(C); m(H) = n(H)×M(H) = 2×n(H2O)×M(H) = [2×m(H2O) / M(H2O)]×M(H); Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr): M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль; M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль Тогда, m(C) = [8,8 / 44]×12 = 2,4 г; m(H) = 2×3,6 / 18 ×1= 0,4 г m(O) = m(CxHyOz) – m(C) – m(H) = 6 – 2,4 – 0,4 = 3,2 г Определим химическую формулу соединения: x:y:z = m(C)/Ar(C) : m(H)/Ar(H) : m(O)/Ar(O); x:y:z= 2,4/12 :0,4/1 :3,2/16; x:y:z= 0,2 : 0,4 : 0,2 = 1: 2 : 1 Значит простейшая формула соединения CH2O и молярную массу 30 г/моль [M(CH2O) = Ar(C) + 2×Ar(H) + Ar(O) = 12 + 2×1 + 16 = 12 + 2 + 16 = 30 / моль]. Чтобы найти истинную формулу органического соединения найдем отношение истинной и полученной молярных масс: Msubstance / M(CH2O) = 180 / 30 = 6 Значит индексы атомов углерода, водорода и кислорода должны быть в 6 раз выше, т.е. формула вещества будет иметь вид C6H12O6. Это глюкоза или фруктоза. |
| Ответ | C6H12O6 |
| Задание | Определите молекулярную формулу соли с молярной массой менее 300, в которой массовые доли азота, водорода, хрома и кислорода составляют 11,11%; 3,17%; 41,27% и 44,44% соответственно. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле:
ω (Х) = n × Ar (X) / M (HX) × 100% Обозначим число атомов азота в молекуле через «х», число атомов водорода через «у», число атомов хрома за «z» и число атомов кислорода за «k». Найдем соответствующие относительные атомные массы элементов железа и кислорода (значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел). Ar(N) = 14; Ar(H) = 1; Ar(Cr) = 52; Ar(O) = 16 Процентное содержание элементов разделим на соответствующие относительные атомные массы. Таким образом мы найдем соотношения между числом атомов в молекуле соединения: x:y:z:k = m(N)/Ar(N) : m(H)/Ar(H) : m(Cr)/Ar(Cr) : m(O)/Ar(O); x:y:z:k= 11,11/14 :3,17/1 :41,27/52 : 44,44/16; x:y:z:k= 0,79 : 3,17 : 0,79 : 2,78 = 1: 4 : 1 : 3,5 = 2 : 8: 2 : 7 Значит простейшая формула соединения азота, водорода, хрома и кислорода имеет вид N2H8Cr2O7 или (NH4)2Cr2O7. Это дихромат аммония. |
| Ответ | (NH4)2Cr2O7 |











