Формула оксида натрия
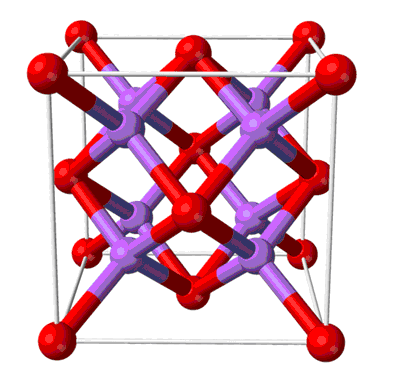
Определение и формула оксида натрия
Химическая формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – белое термически устойчивое тугоплавкое твердое вещество.
Химические свойства оксида натрия
- При нагревании выше
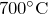 разлагается на пероксид натрия и натрий:
разлагается на пероксид натрия и натрий:
![Rendered by QuickLaTeX.com \[ 2Na_2O = Na_2O_2 + 2Na \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-a3a844150e9513cac8f77a6c3efef16c_l3.png)
- Энергично взаимодействует с водой с образованием сильнощелочного раствора:
![Rendered by QuickLaTeX.com \[ Na_2O + H_2O = 2NaOH \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-7b404d9a3630d06141b45ba51dc455b7_l3.png)
- Поскольку является основным оксидом, то реагирует с кислотами и кислотными оксидами:
![Rendered by QuickLaTeX.com \[ Na_2O + CO_2 = Na_2CO_3 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-869410e95f59cedef10f4168c2012745_l3.png)
- При высокой температуре реагирует с оксидом алюминия:
![Rendered by QuickLaTeX.com \[ Na_2O + Al_2O_3 = 2NaAlO_2 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-297fc817e165014e1e80e3b8caa9b19c_l3.png)
Получение
Один из способов получения оксида натрия основан на разложение пероксида натрия при сильном нагревании:
![]()
Также оксид натрия образуется при взаимодействии натрия с гидроксидом натрия:
![]()
При термическом ![]() разложении карбоната натрия также образуется оксид натрия:
разложении карбоната натрия также образуется оксид натрия:
![]()
Применение
Оксид натрия, как правило, используется в качестве реактива для различных неорганических синтезов, а именно в основном для получения гидроксида натрия.
Примеры решения задач
| Задание | Оксид натрия с массой |
| Решение | Запишем уравнение химического взаимодействия оксида натрия с водой:
Найдем количество моль оксида натрия, взятого для растворения: Из Найдем массу полученного раствора. Поскольку плотность воды равна 1 г/мл, то объем воды будет равен ее массе, тогда: Определим массовую долю гидроксида натрия в полученном растворе: |
| Ответ |
| Задание | Сколько грамм натрия потребуется для получения |
| Решение | Запишем гипотетическую реакцию образования Из стехиометрии реакции найдем количество моль натрия: Определим массу натрия и его долю: |
| Ответ |











