Формула оксида азота
Определение и формула оксида азота
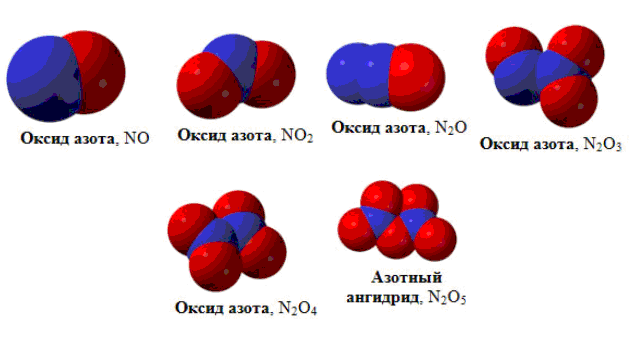
Известно несколько оксидов азота, в которых азот имеет разные степени окисления.
Оксид диазота
Химическая формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Другие названия — «Веселящий газ», закись азота.
Физические свойства – в обычных условиях бесцветный термически устойчивый газ.
Несолеобразующий оксид, слабый окислитель и слабый восстановитель.
Химические свойства оксида диазота
- При нагревании выше
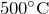 разлагается на азот и кислород:
разлагается на азот и кислород:
![Rendered by QuickLaTeX.com \[ 2N_2O = 2N_2 + O_2 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-4069584d527e74c6eed34bca04c9338d_l3.png)
- Реагирует с металлами при нагревании
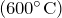 :
:
![Rendered by QuickLaTeX.com \[ N_2O+Mg = N_2 +MgO \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-8a2d2ef18a8415e3e6ccda5ed75d984d_l3.png)
- Вступает в реакции окисления-восстановления:
![Rendered by QuickLaTeX.com \[ 5N_2O+3H_2SO_4+2KMnO_4=10NO+2MnSO_4 +K_2SO_4 +3H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-1bf172271461b3e70e0ee65376552c57_l3.png)
Получение
Один из способов получения закиси азота основан на разложении нитрата аммония при ![]() :
:
![]()
Монооксид азота
Формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – бесцветный газ, голубая жидкость.
В твердом состоянии полностью димеризован, термически устойчивый.
Несолеобразующий оксид, слабый окислитель и слабый восстановитель, плохо растворяется в воде.
Химические свойства монооксида азота
- При нагревании выше
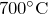 разлагается на азот и кислород:
разлагается на азот и кислород:
![Rendered by QuickLaTeX.com \[ 2NO = N_2 + O_2 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-028c7aecacd1b2773191f6ef714313f8_l3.png)
- Реагирует с водородом при нагревании
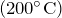 :
:
![Rendered by QuickLaTeX.com \[ 2NO+2H_2 = N_2 + 2H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-349d585618656e70adcf44a3c0b60b44_l3.png)
- Вступает в реакции окисления-восстановления:
![Rendered by QuickLaTeX.com \[ 2NO+H_2O+3HClO=2HNO_3+3HCl \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-cdf1be665d76f0a3f6caf6cd224d2585_l3.png)
Получение
Один из способов получения закиси азота основан на взаимодействии аммиака с кислородом при ![]() в присутствии катализатора:
в присутствии катализатора:
![]()
Триоксид азота
Формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – синяя жидкость, термически неустойчивая.
В твердом состоянии имеет голубоватый цвет.
Солеобразующий оксид.
Химические свойства триоксида азота
- При комнатной температуре разлагается на
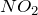 и
и 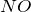 :
:
![Rendered by QuickLaTeX.com \[ N_2O_3=NO_2+NO \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-65f8d9ce5f62703bdacb971148c24bee_l3.png)
- Реагирует с
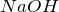 с образованием нитрита натрия:
с образованием нитрита натрия:
![Rendered by QuickLaTeX.com \[ N_2O_3 + 2NaOH = 2NaNO_2 + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-f15100e8716687f4e440f5d19dbaacac_l3.png)
- Вступает в реакции окисления-восстановления:
![Rendered by QuickLaTeX.com \[ N_2O_3 + 3Cu = N_2 + 3CuO \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-1bf4e8d0fc2e396b414f474f713cc8f3_l3.png)
Получение
Один из способов получения триоксида азота основан на взаимодействии диоксида азота с водой:
![]()
Диоксид азота
Формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – бурый газ, в жидком состоянии димер бесцветен, в твердом состоянии белый.
Хорошо растворяется в холодной воде и реагирует с ней.
Сильный окислитель.
Химические свойства диоксида азота
- При нагревании разлагается на
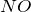 и
и 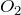 :
:
![Rendered by QuickLaTeX.com \[ 2NO_2=NO + 2O_2 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-6c823adc44fcd0e91892e1eb572689b6_l3.png)
- Реагирует с
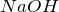 с образованием нитрита и нитрата натрия:
с образованием нитрита и нитрата натрия:
![Rendered by QuickLaTeX.com \[ 2NO_2 + 2NaOH = NaNO_2 + NaNO_3+H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-2b09a80854e086715a593291ffe5eac1_l3.png)
- Вступает в реакции окисления-восстановления:
![Rendered by QuickLaTeX.com \[ 4NO_2+3H_2SO_4 + 6FeSO_4 = N_2 + 3Fe_2(SO_4)_3 + 2H_2O+2HNO_3 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-2897d14e8ba1753854103aafa76a09cb_l3.png)
Получение
Один из способов получения триоксида азота основан на взаимодействии диоксида азота с водой:
![]()
Пентаоксид азота
Формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – белое твердое вещество, бесцветный газ и бесцветная жидкость.
При нагревании возгоняется и плавится.
Солеобразующий оксид, ангидрид азотной кислоты.
Химические свойства пентаоксида азота
- При комнатной температуре за 10 часов разлагается на
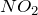 и
и 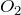 :
:
![Rendered by QuickLaTeX.com \[ 2N_2O_5=4NO_2+O_2 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-920fa7ea13183fce540a455ce08a898e_l3.png)
- Реагирует с
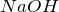 с образованием нитрата натрия:
с образованием нитрата натрия:
![Rendered by QuickLaTeX.com \[ 2N_2O_5 + 2NaOH = 2NaNO_3+H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-557e5432ca64126c5443d6bd2a0b5404_l3.png)
- Вступает в реакции окисления-восстановления:
![Rendered by QuickLaTeX.com \[ N_2O_5 + 5Cu = 5CuO + N_2 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-2e197f0775fc7f15824e3448fcad2722_l3.png)
Получение
Один из способов получения пентаоксида азота основан на взаимодействии реакции:
![]()
Примеры решения задач
| Задание | Какой процесс более энергетически затратен по тепловому эффекту при стандартных условиях: |
| Решение | Определим изменение энтальпии для первой и второй реакции по справочным данным:
Окисление азота до |
| Ответ |
| Задание | Определите строение и тип гибридизации |
| Решение | Рассмотрим как образуется данная молекула:
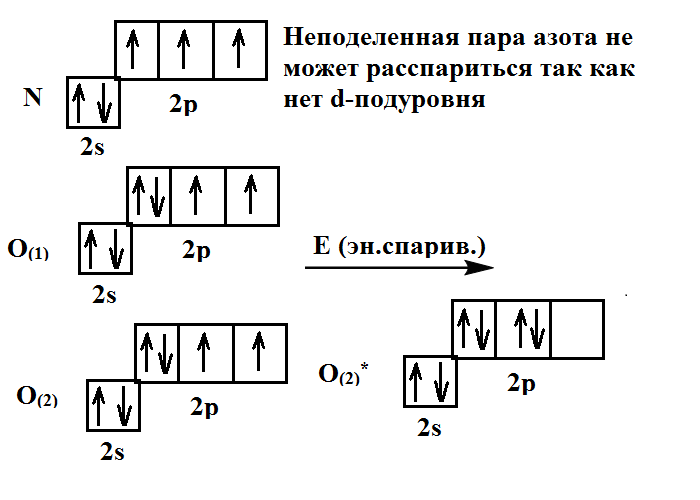
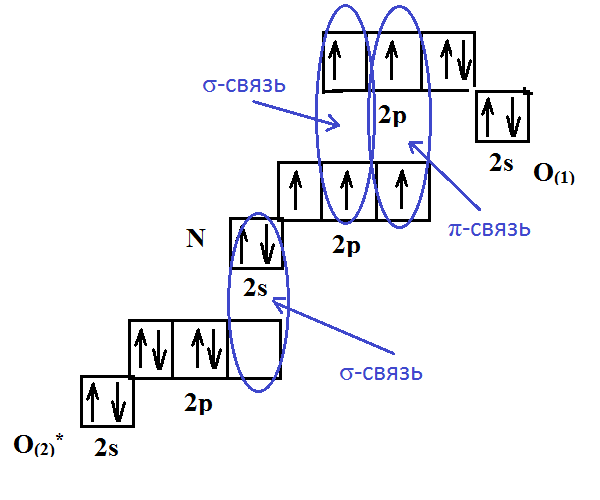
Таким образом, тип гибридизации |
| Ответ |











