Формула метана
Определение и формула метана
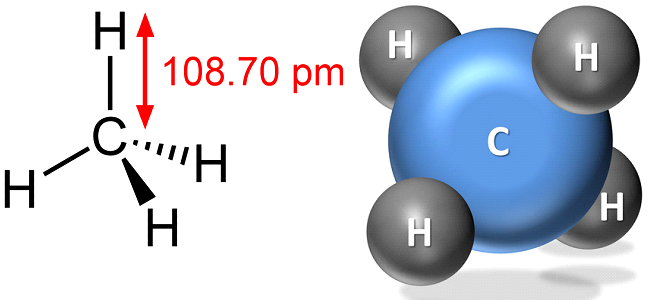
Формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
Физические свойства – в обычных условиях бесцветный газ, не имеющий запаха.
Плохо растворяется в воде.
Известный физик А. Вольта обнаружил метан в болоте в 1776 году.
Метан является главным компонентом природного газа, он содержится в больших количествах в атмосфере газовых гигантов.
Химические свойства метана
- Метан взаимодействует с галогенами при облучении светом по радикальному механизму:
![Rendered by QuickLaTeX.com \[ CH_4 + Cl_2 = CH_3Cl + HCl \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-e56c4ceb18644497473641913a5f7be6_l3.png)
- Подвергается нитрованию разбавленной азотной кислотой при нагревании:
![Rendered by QuickLaTeX.com \[ CH_4 + HNO_3 = CH_3NO_2 + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-bde4b974ae2acd53bdc50494c87ba3a9_l3.png)
- Может реагировать с аммиаком при температуре приблизительно
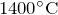 . При этом образуется синильная кислота
. При этом образуется синильная кислота  .
.
- Может взаимодействовать с водой при температуре
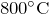 на никелевом катализаторе:
на никелевом катализаторе:
![Rendered by QuickLaTeX.com \[ CH_4 + H_2O = CO + H_2 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-495aa649c1a43e0725fb5c2c42af3319_l3.png)
- Термически разлагается при температуре
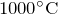 на ацетилен и водород:
на ацетилен и водород:
![Rendered by QuickLaTeX.com \[ CH_4 = C_2H_2 + H_2 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-f6cc4da0412cc8338e79b404d67194af_l3.png)
Получение
В лабораторных условиях метан получают нагреванием безводного гидроксида натрия с ледяной уксусной кислотой:
![]()
Другой способ получения основывается на сплавлении ацетата натрия с ![]() :
:
![]()
Применение
Метан широко используется в качестве промышленного и бытового газа. химически перерабатывается главным образом в ацетилен, газовую сажу, фторо- и хлоропроизводные.
Примеры решения задач
| Задание | Рассчитайте энергию связи |
| Решение | Запишем химическую реакцию, при которой метан разлагается на углерод и атомы водорода:
Определим изменение энтальпии этой реакции: Данная энергия соответствует разрыву четырех связей
|
| Ответ | |
| Задание | Рассчитайте изменение стандартной энергии Гиббса сольватации |
| Решение | Процесс сольватации метана соответствует процессу растворения Запишем выражение для константы равновесия этого процесса: В данном случае за стандартное состояние вещества в газообразном состоянии принята 1 атмосфера, а в растворе Данная константа является константой Генри с размерностью моль/(л Ее численное значение возьмем из справочника: Изменение стандартной энергии Гиббса рассчитаем по уравнению нормального сродства: |
| Ответ | |











