Формула меди
Определение и формула меди
Медь характеризуется исключительной пластичностью и превосходит другие металлы по теплопроводности и электрической проводимости. Плотность 8,94 г/см3. Температура плавления 1084,5oC, кипения 2540oC.

Рис. 1. Медь. Внешний вид.
Химическая формула меди
Химическое обозначение меди – Cu от латинского слова «cyprum». Этот химический элемент расположен в четвертом периоде в IВ группе Периодической таблицы Д.И. Менделеева.Относится к элементам d-семейства. Металл. Относительная атомная масса меди равна 63,546 а.е.м.
Электронная формула меди
В ядре атома меди содержится 29 протонов и 35 нейтронов (массовое число равно 64). В атоме меди есть четыре энергетических уровня, на которых находятся 29 электронов (рис. 2).
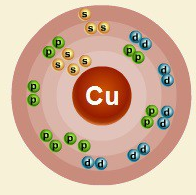
Рис. 2. Строение атома меди.
Электронная формула атома меди в основном состоянии имеет следующий вид:
1s22s22p63s23p63d104s1.
Примеры решения задач
| Задание | Определите простейшую формулу вещества, в котором массовые доли натрия, фосфора и кислорода составляют 34,59, 23,31 и 42,10% соответственно. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле:
ω (Х) = n × Ar (X) / M (HX) × 100% Обозначим число атомов натрия в молекуле через «х», число атомов фосфора через «у» и число атомов кислорода за «z». Найдем соответствующие относительные атомные массы элементов натрия, фосфора и кислорода (значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел). Ar(Na) = 23; Ar(P) = 31; Ar(O) = 16 Процентное содержание элементов разделим на соответствующие относительные атомные массы. Таким образом мы найдем соотношения между числом атомов в молекуле соединения: x:y:z = m(Na)/Ar(Na) : m(P)/Ar(P) : m(O)/Ar(O); x:y:z = 34,59/23 : 23,31/31 : 42,10/16; x:y:z = 1,5 : 0,75 : 2,63 = 2: 1 : 3,5 = 4 : 4: 7 Значит простейшая формула соединения натрия, фосфора и кислорода имеет вид Na4P4O7. |
| Ответ | Na4P4O7 |
| Задание | Определите молекулярную формулу вещества, состоящего из кислорода, азота, фосфора и водорода, если известно, что оно содержит по массе 48,48% кислорода, число атомов азота в нем в два раза больше числа атомов фосфора, а количество атомов водорода в соединении в 2,25 раза больше количества атомов кислорода. Молярная масса вещества меньше 200 г/моль. |
| Решение | Обозначим число атомов кислорода в молекуле через «х», число атомов азота через «у», число атомов фосфора за «z» и число атомов водорода за «k».
Найдем соответствующие относительные атомные массы элементов азота, фосфора, водорода и кислорода (значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел). Ar(N) = 14; Ar(P) = 31; Ar(H) = 14; Ar(O) = 16 Пусть масса неорганического вещества равна 100 г, тогда масса кислорода составляет m(О) = 48,48 г. Найдем количество вещества кислорода: n(О) = m(О) / М(О); n(О) = 48,48 / 16 = 3,03 моль Согласно условию задачи n(Н) = n(О) ×2,25, т.е. n(Н) = 3,03 × 2,25 = 6,82 моль Тогда масса водорода будет равна: m(Н) = n(Н) × М(Н); m(Н) = 6,82 ×1 = 6,82 г Найдем суммарную массу элементов азота и фосфора, входящих в состав соединения: m (N + P) = msubstance — m(О) — m(Н); m (N + P)= 100 – 48,5 – 6,82 = 44,68 г Запишем уравнения для нахождения массы каждого из элементов в отдельности: m(N) = n(N) × M(N); m(N) = 14× n(N) m(P) = n(P) × M(P); m(P) = 31× n(P) Составим систему уравнений и решим ее: 14× n(N) + 31× n(P) = 44,68; n(N) = 2× n(P) 28 n(Р) + 31n (P) = 44,68; 59 n(Р) = 44,68; n(Р) = 0,757 моль n(N) = 2× 0,75= 1,514 моль Процентное содержание элементов разделим на соответствующие относительные атомные массы. Таким образом мы найдем соотношения между числом атомов в молекуле соединения: x:y:z:k = n(О) : n(N) : n(Р) : m(Н); x:y:z:k= 3,03 : 1,514 : 0,757 : 6,82; x:y:z:k= 4 : 2 : 1 : 9 Значит простейшая формула соединения будет иметь вид O4N2PH9. Молекулярная формула вещества может содержать удвоенное, утроенное и т.д. число атомов. Чтобы убедиться в том, что молекулярная формула вещества совпадает с простейшей, подсчитаем молярную массу: М(O4N2PH9) = Ar(O) ×4 + Ar(N) ×2 + Ar(P) + Ar(H) ×9; М(O4N2PH9) = 16×4 + 14×2 + 31 + 1×9 = 132 г/моль. 132 < 200 Очевидно, что молярная масса для удвоенной формулы будет больше 200, что противоречит условию задачи, следовательно, молекулярная формула вещества O4N2PH9.Перегруппировав атомы легко догадаться, что это вещество является гидрофосфатом аммония (NH4)2HPO4. |
| Ответ | (NH4)2HPO4 |











