Формула кварца
Определение и формула кварца
Химическая формула – ![]()
Молярная масса равна ![]() г/моль.
г/моль.
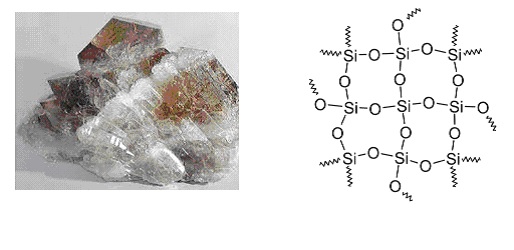
Физические свойства – кварц не имеет цвета, если в нём имеются примеси, то он может принимать различную окраску.
Температура плавления ![]() , плотность 2,6—2,65 г/см
, плотность 2,6—2,65 г/см![]() , при комнатной температуре существует в
, при комнатной температуре существует в ![]() -форме, при
-форме, при ![]() переходит в
переходит в ![]() -форму, энтальпия этого перехода равна 0,41 кДж/моль.
-форму, энтальпия этого перехода равна 0,41 кДж/моль.
В воде нерастворим, один из самых лучших диэлектриков. Является стеклообразующим оксидом.
Хорошо растворяется в воде (сильный гидролиз по аниону), создает сильнощелочную среду:
Химические свойства кварца
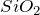 – это кислотный оксид, поэтому он взаимодействует со щелочами, с оксидами щелочных и щелочноземельных металлов, также он реагирует с HF, c содой, с сильными восстановителями:
– это кислотный оксид, поэтому он взаимодействует со щелочами, с оксидами щелочных и щелочноземельных металлов, также он реагирует с HF, c содой, с сильными восстановителями:
![Rendered by QuickLaTeX.com \[ SiO_2 + 2NaOH = Na_2SiO_3 + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-ae57daa6807b1d30549e5a86b87932b2_l3.png)
![Rendered by QuickLaTeX.com \[ SiO_2 + CaO = CaSiO_3 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-d87ad7b2f011628eea8c65ebca86ac62_l3.png)
![Rendered by QuickLaTeX.com \[ SiO_2 + 6HF = H_2[SiF_6] + 2H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-7d184d147f7a0939f8462354fa91b185_l3.png)
![Rendered by QuickLaTeX.com \[ SiO_2 + Na_2CO_3 = Na_2SiO_3 + CO_2 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-c30552f9d5edefe3c0d8ee511bfa4f0a_l3.png)
![Rendered by QuickLaTeX.com \[ SiO_2 + 2Mg = 2MgO + Si \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-4df08db838beff909daa8da36b9d0291_l3.png)
Получение
Кварц можно синтезировать искусственным способом – гидротермальным методом.
Применение
Кварц примеяется в оптических приборах, в микроэлектронике, в производстве стёкол и керамики, используется в ювелирном деле.
Примеры решения задач
| Задание | Рассчитайте давление |
| Решение | Запишем уравнение химического взаимодействия:
Рассчитаем изменение энтальпии и энтропии реакции: Определим изменение энергии Гиббса реакции и константу равновесия: Запишем |
| Ответ |
| Задание | Оцените температуру, при которой реакция получения |
| Решение | Запишем уравнение реакции горения кремния:
Из первой задачи возьмем данные: Рассчитаем температуру, при которой |
| Ответ |











